Enzimlerin biyokimyasal katalizör olduğunu bir önceki yazımızda söylemiştir. Biyokimyasal katalizörler için işleyiş mekanizması ve enzimlerin kinetik hesaplamalarını temel aldığımızda karşımıza çıkan en önemli denklem; enzim kinetiği için temel oluşturan MİCHAELİS-MENTEN EŞİTLİĞİ‘dir.
Katalizörler, Enzim Kinetiği ve Michaelis-Menten Eşitliği
Enzimler her zaman substratla kurdukları ilişki çerçevesinde reaksiyon katalizlerler. Bu ilişkiyi enzim miktarı ve substrat miktarı çerçevesinden, substrat miktarının farklılaşması ile nasıl değiştiğini gösteren aşağıdaki görsell çok iyi bir şekilde özetlemektedir.
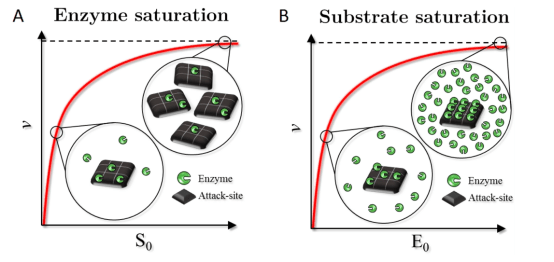
Çözünmeyen substrat üzerinde bir enzimatik reaksiyon için enzim doygunluğu (A) ve substrat doygunluğunun (B) basitleştirilmiş gösterimi. Kırmızı eğri, toplam substrat, S0 (A) veya enzim E0 (B) toplam konsantrasyonuna karşı v başlangıç reaksiyon hızının bir grafiği. Görseller, substratı, enzime yönelik saldırı yerlerini temsil eden alanları (yani, enzimin bağlanabildiği ve hidrolizi başlatabileceği yüzeydeki boşluklar) pullar olarak tasvir eder. Yüksek substrat yüklerinde meydana gelen enzim doygunluğu (A) durumunda, tüm enzim popülasyonu bir komplekse girer (geleneksel Michaelisent Menten doygunluğunda olduğu gibi). Aksi durumda, yüksek enzim konsantrasyonunda meydana gelen substrat doygunluğu (B) için, tüm saldırı bölgeleri enzim ile kompleks hale getirilmektedir.
Kaynak(görsel ve metin için): https://doi.org/10.1021/acscatal.7b00838
Yukarıdaki grafiklere baktığımızda subtrat miktarı ile hızın değişimi iki farklı parametre ile ele alınmış. İlk grafikte enzimin substrat doygunluğu gösteerilirken ikinci grafikte enzim doygunluğu ele alanmış olup, iki şekilde de tepkime hızları (iki grafik arasında orantısal bağlantı bulunmamakta ve tepkime hızlarının sabit kalması için geçen süre farklıdır) bir yerden sonra da sabit kalmıştır.
Katalizör Olarak Enzimler ve Hesaplamalar ile İlgili Temeller
Substrat derişimi ve tepkime hızı arasındaki arasındaki bağlantı grafiksel olarak ifade edilebildiğine göre nicel olarak da ifade edilebilir. Bu bağlamda karşımıza Michaelis-Menten eşitliği çıkmaktadır. Katalizör mantığı ile burada çıkış noktası;
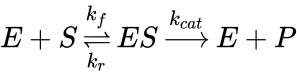
eşitliği olup, bu eşitlik enzimlerin çalışma hızlarının ölçülebilir hale getirilebilmesi için oluşturulmuştur. Enzimlerin çalışmasını somut olarak açıklayan ifade ise;
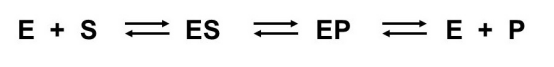
Şeklinde ifade edilir ve burada enzimlerin tepkime dengesine etki etmedikleri açıkça görülür. Michaelis-Menten eşitliğinin çıkarılması için kullanılacak olan ifade kullanılmalıdır;
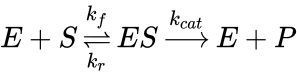
Eşitliği olmak zorundadır. Bu eşitlikte E enzimi, S substratı, ES enzim substrat kompleksini, P ise ürünü ifade etmektedir. Buradan ES oluşum ve yıkım hızları şu şekilde ifade edilir;
ES oluşum hızı= k1 ([Et] – [ES]) [S]
ES yıkım hızı= k-1[ES] + k2[ES]
Yukarıdaki iki denklem kararlı halde birbirine eşitlenebilir;
k1 ([Et] – [ES]) [S] = k-1[ES] + k2[ES]
Yukarıdaki denklemden;
k1[Et][S]-k1[ES][S]=(k-1+k2)[ES]
Yazılır. Sonrasında bu eşitliğin her iki tarafı da k1[ES][S] ifadesiyle çarpılırsa;
k1[Et][S]=(k1[S]+k-1+k2)[ES]
Bulunur ve eşitlik [ES] için çözülürse;
[ES]=k1[Et][S]/k1[S]+k-1+k2
Elde edilir ve sadeleştirme yaparsak;
[ES]={[Et][S]/[S]}+{(k-1+k2)/k1}
Şeklinde hız sabitleri bir araya toplanmış olur. Burada {(k-1+k2)/k1} ifadesi Michaelis sabiti olup Km şeklinde ifade edilir.
[ES]=[Et][S]/(Km+[S])
Halinde gösterilir. Buradan V0’ı [ES] cinsinden ifade etme olanağımız vardır. Bu aşamada bir kaç cebirsel işlemle;
V0=k2[Et][S]/(Km+[S])
Haline dönüştürülen denklem son haline Vmak=k2[Et] ifadesi yerine yazılarak ulaşır.
V0=Vmak[S]/Km+[S]
Eşitliğin son halidir. Bu denklem Michaelis-Menten Eşitliği olarak adlandırılır. Burada Km enzim substrata olan bir ölçüsü olarak nitelendirilir.
Protein yapılar ile ilgili daha fazla bilgi almak için Risin Proteini yazısını okuyabilirsiniz.