İnorganik Kimyada Tepkime ve Mekanizmalar
İnorganik kimyada tepkime pek çok farklı mekanizma üzerinden gerçekleşir. Her mekanizmanın özellikleri farklı olmak ile birlikte, anorganik(inorganik) kimyadaki pek çok tepkime gibi bu mekanizmalar kompleksler üzerinde gerçekleşir. Organik kimyadaki reaksiyon ve mekanizmalara benzer pek çok olay inorganik kimyada da karşımıza çıkar. Bu mekanizmalar ara ürünlerin oluşması, kararlılığı, gözlenebilmesi gibi pek çok konu ile birbirinden ayrılır. Bir birinden farklı olan tüm bu özellikler enerji diagramları ile kolayca ifade edilebilir. Bu tür tepkimeler genellikle metalleri kapsar ve bir enzim veya protein yapının içerisinde metal iyonlarının bulunması oldukça dikkat çekici bir özellik olarak karşımıza çıkar. Çünkü metal iyonları protein yapının veya enzimin içerisinde de metal bağlanma bölgeleri içeren maddelerle kompleks yapılar oluşturur. Bu konuda daha ayrıntılı bilgi için enzimler ile ilgili yazımızı okuyabilirsiniz. Metal iyonu içeren enzimlerden biri olan karbonik anhidraz IX’in görüntüsü, metal iyonu yakınlaştırılarak gösterilmiştir..
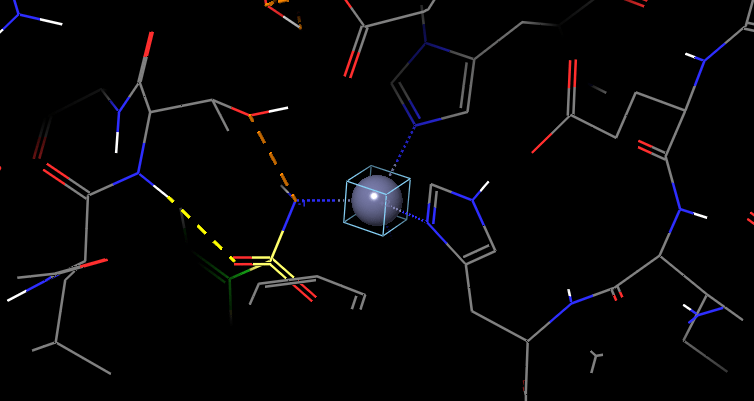
DOI: 10.2210/pdb5FL6/pdb
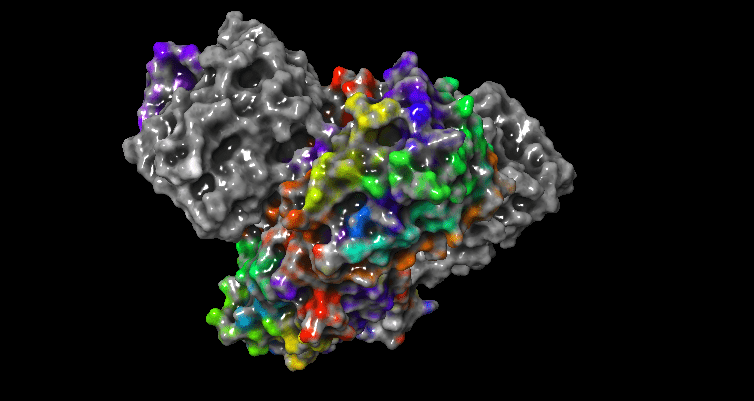
DOI: 10.2210/pdb5FL6/pdb
Birleşmeli Mekanizmaları
Birleşmeli mekanizmalar için; hız belirleyen basamakta merkez atomun koordinasyon sayısı artıyorsa, tepkime birleşmeli mekanizmaya sahiptir. Geçiş kompleksinde iki molekülün kimyasal bağlarında değişiklik olacağından tepkime aynı zamanda bimoleküler nükleofilik yerdeğiştirme tepkimesidir (SN2). Burada hız belileyen basamakta ligant merkez atomuna bağlanmaktadır.
Aradeğişim mekanizması için; bir takas veya gizli tepkimede kompleks ile gelen ligant arasında hızlı bir denge kurulur, sonuçta bir iyon çifti veya zayıf bağlı bir molekül meydana gelir. Bu geçiş halindeki türler doğrudan ölçülememiştir ve koordinasyon sayısını arttırdığı da söylenemez. Daha sonra, komplekse bağlı bulunan bir ligant ayrılır ve yeni bir ürün oluşur. Ara maddenin gözlenmediği böyle mekanizmaların eş zamanlı olduğu söylenir. Ara değişim mekanizması altılı koordinasyonlar için geçerlidir.
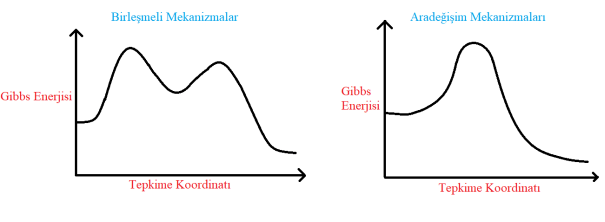
Aşağıda elektron aktarımı bir kompleksten diğerinedir. İki molekül bir ligant vasıtasıyla birbirleriyle temas ediyorsa ve elektron bu yolla aktarılıyorsa bunlara köprü veya iç-küre tepkimeleri adı verilir.
Örnek Tepkime
İç-küre mekanizmasının tanımından yola çıkarak, NCS ligantının da çift dişli olduğu göz önüne alındığında X yerine NCS gelmelidir. Tepkimenin mekanizması da aşağıdaki gibidir.
Burada NCS çift dişli olarak davranacak ve bir ucundan kobalta bağlanırken diğer ucundan kroma bağlanarak elektron aktarımında köprü görevi görecektir. Bunun nedeni de π elektronlarına ya da p orbitallerine sahip ligantlar (π -verici ve π -alıcı ligantlar) tünelleme için iyi bir güzergah sağlayabilirler. Öteyandan H2O, NH3 hem bu özelliğe sahip olmadığı için hem de fazla yalın çift içermeyen ve düşük enerjili karşı bağ orbitalleri olmayan ligantlar tünel oluşturamayacağı için bu tepkimede X’in yerinde kullanılamazlar.
Tepkime Nasıl Gerçekleşti
NCS ligantında azot kobalt ile bağ yapacaktır. Çünkü N dan bağlı [(NH3)5CoNCS]2+kompleksi, serbest S atomundan bağlanarak tepkime verir, çünkü siyanür sert olan Co2+katyonunu yumuşatmıştır. S den bağlı [(NH3)5CoSCN]2+kompleksi, önce serbest N atomundan bağlanarak tepkime verir, sonra hızlı bir düzenlenme ile daha kararlı olan S’den bağlı yapıya dönüşür.
Tepkimenin ara basamaklarında ise N atomu kobalta bağlı olacaktır ve S atomu da kroma bağlı olarak elektron aktarımı gerçekleştirecektir.
Tüm bu mekanizmalar ve tepkime örnekleri inorganik kimyadaki tepkimelerin ve tepkime mekanizmalarının küçük bir kısmını kapsamaktadır. İnorganik tepkimeler enzimlerin içerisindeki metal atomları ile de belirli koşullarda etkileşim haline girmektedir. Bu etkileşimin çeşidi, yapısı ve özellikleri tamamen enzime ve etkileşen moleküle bağlıdır. Bu konuyu daha iyi anlamak için viral bir enzim olan HIV integraz enzimin içerisindeki iki adet artı yüklü magnezyum atomu gösterilebilir. Bu enzimin içerisindeki metal atomları olası inhibitör molekülleri ile çeşitli etkileşimlere girmekte ve enzim bu şekilde inhibe edilmektedir. Metal atomlarına bağ yapılması sonucu gerçekleşen bu etkileşimi Raltegravir – İntegraz İnhibitörlerinin İlki adlı yazıdan okuyabilirsiniz. Ayrıca inorganik tepkime mekanizmaları sonucu elde edilen koordinasyon bileşikleri ile ilgili daha çok bilgi almak için Potasyum Permanganat (KMnO4) adlı yazıyı okuyabilirsiniz.



