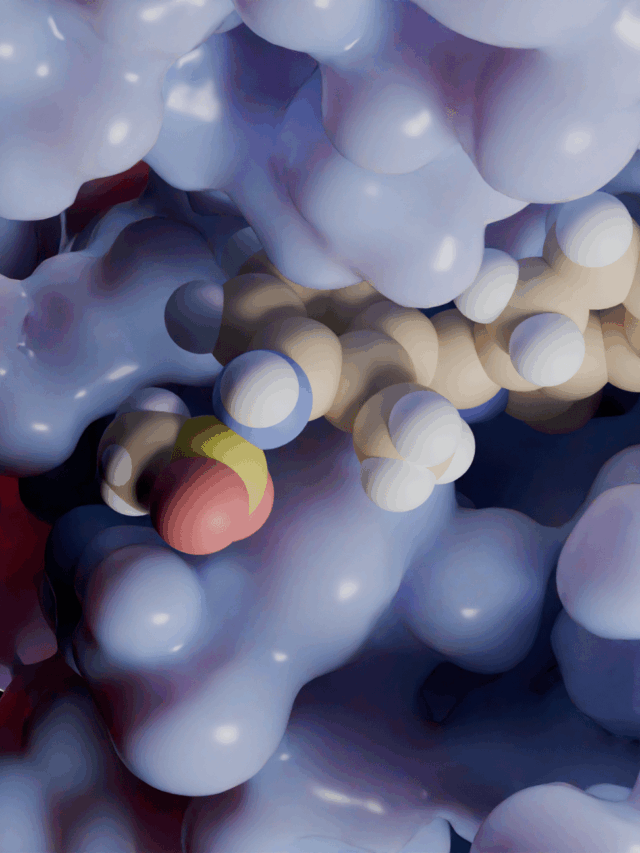Bir Bakteriyel Alarmon Enzimi – (p)ppApp Sentetaz (PDB 8VX3)Bir Bakteriyel Alarmon Enzimi – (p)ppApp Sentetaz (PDB 8VX3)
Recommended for you
Glukozidaz Enziminin Allosterik İnhibisyonunda Substratın Aktif Bölgeden Çıkarılması
Bir Bromodomain İnhibitörü ile Sıtma İlacını Keşfetmek: Bir Moleküler Dinamik Simülasyonu
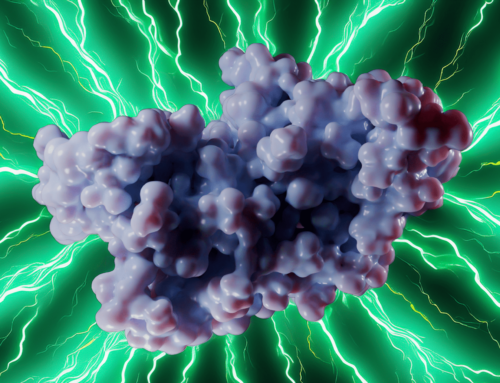
Bir Bakteriyel Alarmon Enzimi – (p)ppApp Sentetaz (PDB 8VX3)
AMPK’nın Çarpıcı 4K Moleküler Dinamiği (PDB 3AQV) | Bilim Sanatla Buluşuyor
Alfa-Glukozidaz’da Allosterik İnhibisyon: 4K Hiper-Gerçekçi Moleküler Dinamik Simülasyonu
Aktif Bölgeye Gömülü Bir Ligandın Zamana Bağlı Hareketi
(p)ppApp Sentetaz Nedir?
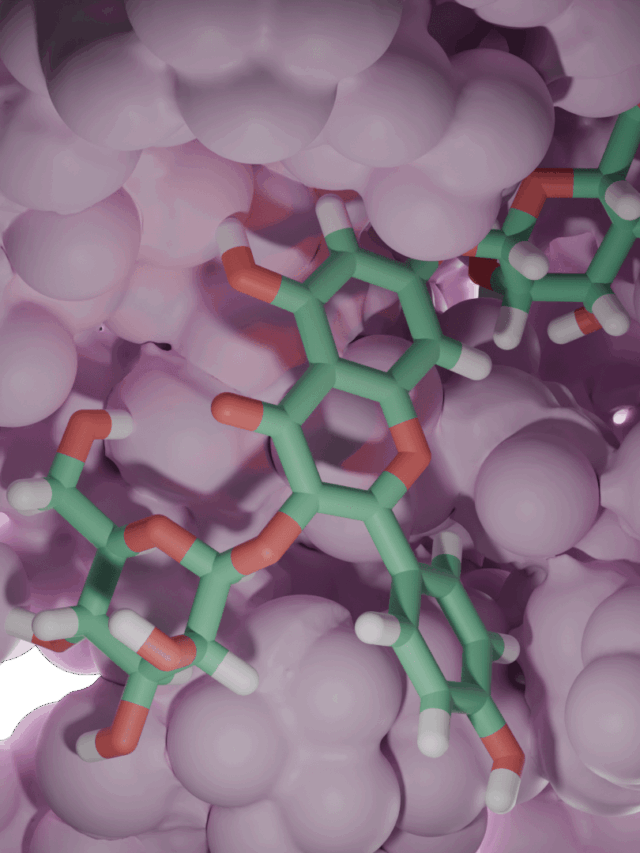
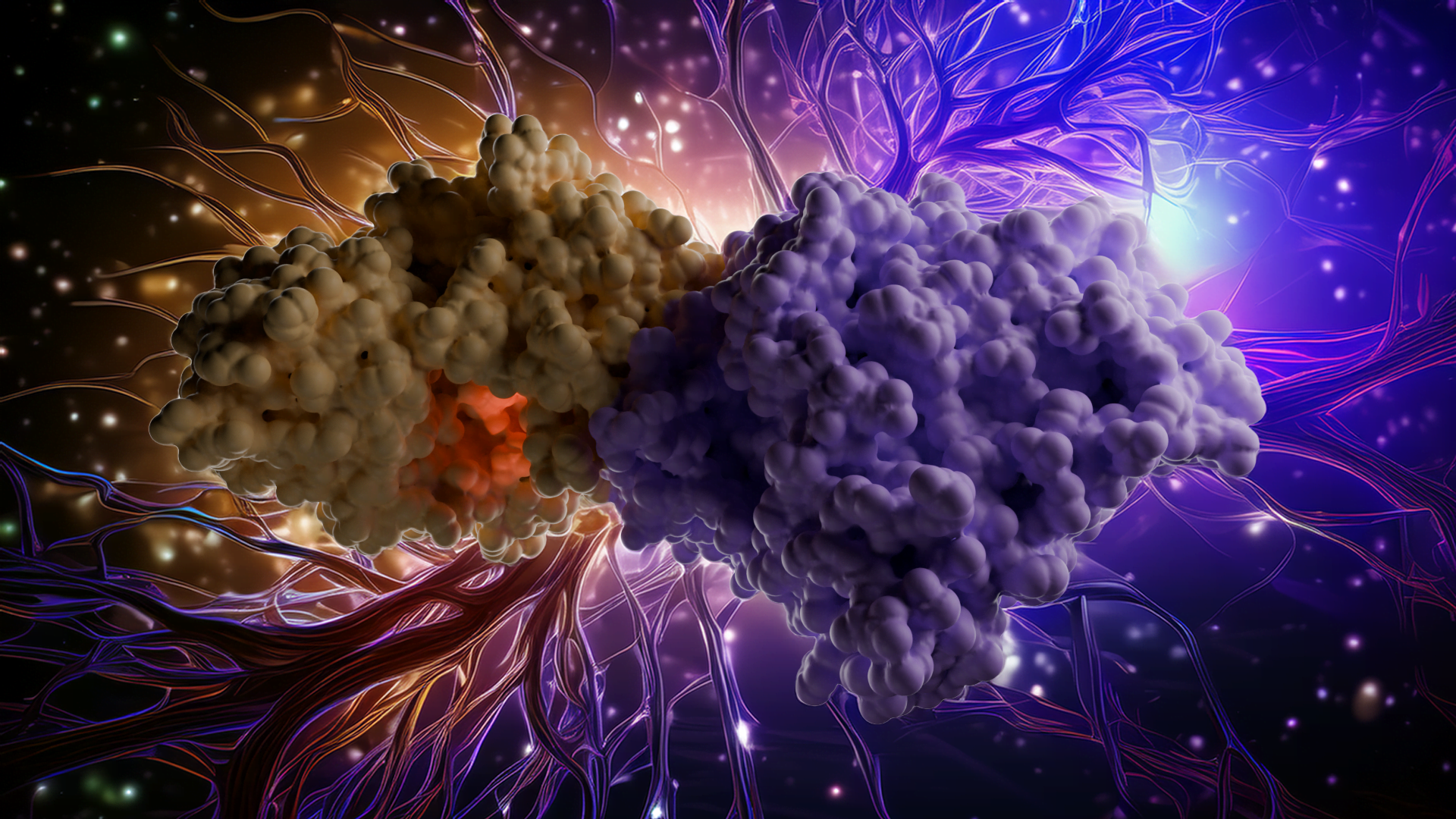
Streptomyces albidoflavus’tan (p)ppApp sentetaz analizimizle bakteriyel savaşın moleküler dünyasına dalın! Bu enzim bakteriyel bir alarmon sentetazdır – bir hücrenin metabolizmasını saniyeler içinde durdurabilen olağandışı nükleotid habercileri oluşturur. Kristal yapısını (PDB ID: 8VX3) inceleyerek, şeklinin ve aktif bölgesinin hücrenin enerji para birimini (ATP) ele geçirmesine ve onu toksik bir sinyale dönüştürmesine nasıl izin verdiğini ortaya koyuyoruz.
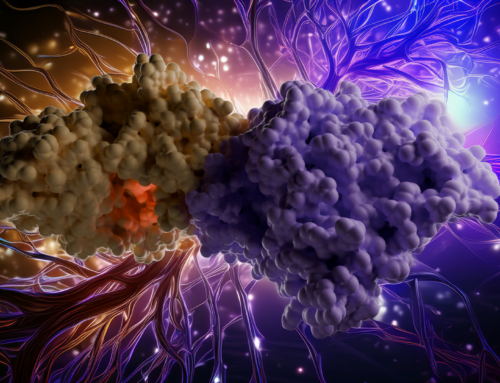
Bu videoda enzimin işlevsel rolünü açıklıyoruz: Bir fabrikanın güç jeneratörünün aniden tüm elektriği hiçbir makinenin kullanamayacağı bir forma dönüştürdüğünü hayal edin – (p)ppApp’ın bir bakteri hücresinde yaptığı şey budur. Bu enzim (p)ppApp üreterek ATP’yi (hücrenin “pili”) tüketir ve hayati süreçleri durdurarak hücre üzerindeki “kapatma düğmesini” etkili bir şekilde kapatır. Ayrıca, bir bakterinin rakibinin altyapısını nasıl sabote edebileceğini göstermek için bir şehir kesintisine benzetme yapıyoruz. Bu (p)ppApp sentetaz genellikle bakteriler arası rekabette bir toksin olarak kullanılır, yani bakteriler bunu komşularına karşı bir silah olarak kullanır. Bu akıllıca bir stratejinin parçasıdır: enzim bir rakibe enjekte edilerek kurbanın enerjisinin tükenmesine ve büyümesinin durmasına neden olur.
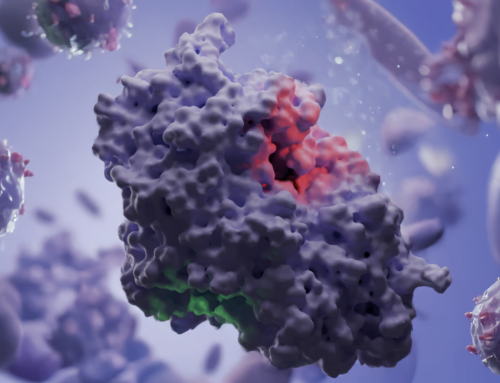
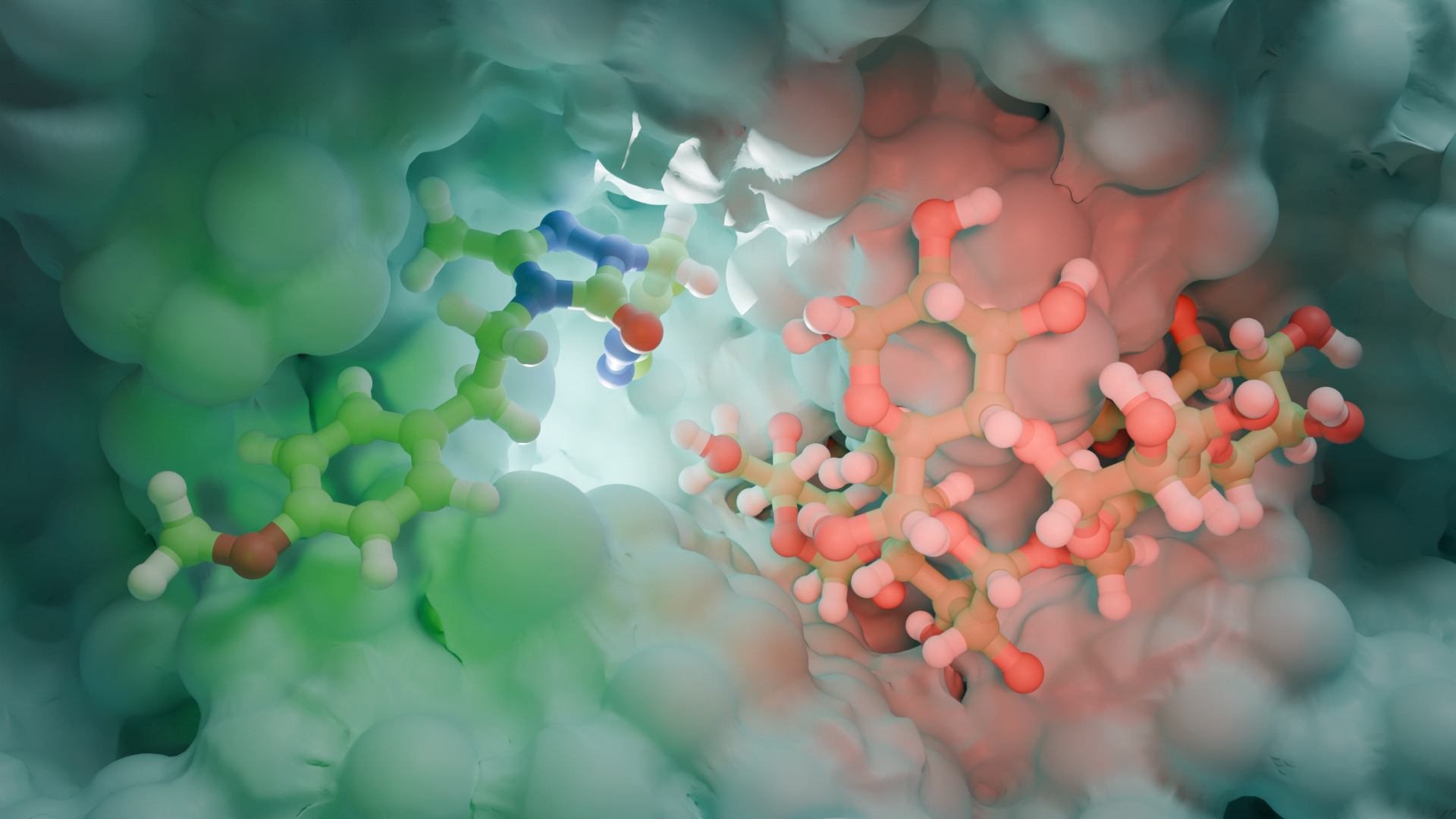
Daha sonra, enzimin bağlanma bölgelerini ve katalitik kalıntılarını yakınlaştırıyoruz. 3D yapı, iki nükleotid için mükemmel boyutta bir cep gösteriyor: biri pirofosfat verirken diğeri (bir ADP veya ATP) onu alıyor. Aktif bölgedeki kilit bir amino asit, alıcı molekülün 3′-OH grubunu aktive etmek için katalitik bir baz görevi görerek ATP’den bir pirofosfatın transferini sağlar. Bu süreci, enzimin ATP’den pirofosfatı almak için substratı hazırladığı bir yarıştaki bayrak teslimine benzetiyoruz. Özel olarak tasarlanmış aktif bölgesi sayesinde enzim özellikle adenozin bazlı molekülleri hedef alarak (p)ppGpp yerine (p)ppApp yapmasını sağlar.
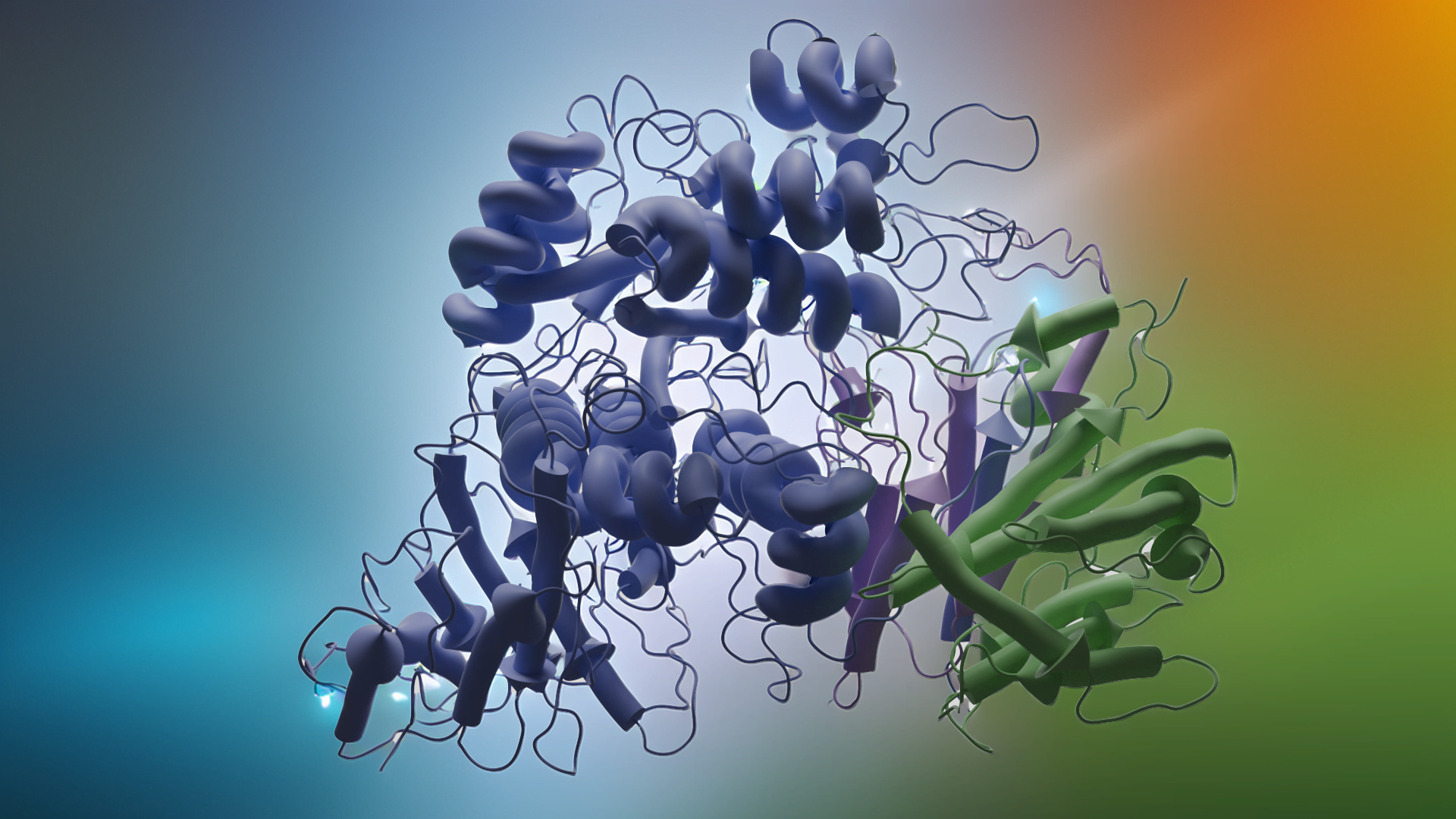
Ayrıca ilgili proteinlerle yapısal karşılaştırmaları da vurguluyoruz. (p)ppApp sentetaz 207 amino asitlik tek bir protein olmasına rağmen, aktif durumda bir homotetramer oluşturur. Bu yapı, tüm parçaların uyum içinde çalışması gereken çok motorlu bir sistemi anımsatır. Birden fazla etki alanına sahip olan ve ikili roller üstlenen daha büyük RelA/SpoT proteinlerinin aksine, Streptomyces enzimi yalnızca senteze adanmış bir uzmandır ve bu da onu son derece verimli kılar. Hızlı bir şekilde alarmon molekülleri üretme kabiliyeti onu mikrobiyal rekabette güçlü bir araç haline getirmektedir.
Son olarak, enzimin daha geniş biyolojik önemini tartışıyoruz. (p)ppApp sentetaz, bakterilerde yeni bir nükleotid ikinci haberci sistemini temsil etmektedir. Yapısının ve işlevinin anlaşılması, yenilikçi antibiyotik stratejilerinin veya biyoteknolojik uygulamaların önünü açabilir. Bu büyüleyici enzimin moleküler dinamiklerini canlandırırken, ayrıntılı yapısal bilgileri mikrobiyal hayatta kalma ve rekabet için gerçek dünyadaki sonuçlarla ilişkilendirirken bize katılın.
Referanslar
- Bartoli, J., Tempier, A. C., Guzzi, N. L., Piras, C. M., Cascales, E., & Viala, J. P. (2023). Characterization of a (p) ppApp Synthetase Belonging to a New Family of Polymorphic Toxin Associated with Temperate Phages. Journal of Molecular Biology, 435(21), 168282. https://doi.org/10.1016/j.jmb.2023.168282
- Ahmad, S., Wang, B., Walker, M. D., Tran, H. K. R., Stogios, P. J., Savchenko, A., … & Whitney, J. C. (2019). An interbacterial toxin inhibits target cell growth by synthesizing (p) ppApp. Nature, 575(7784), 674-678. https://www.nature.com/articles/s41586-019-1735-9