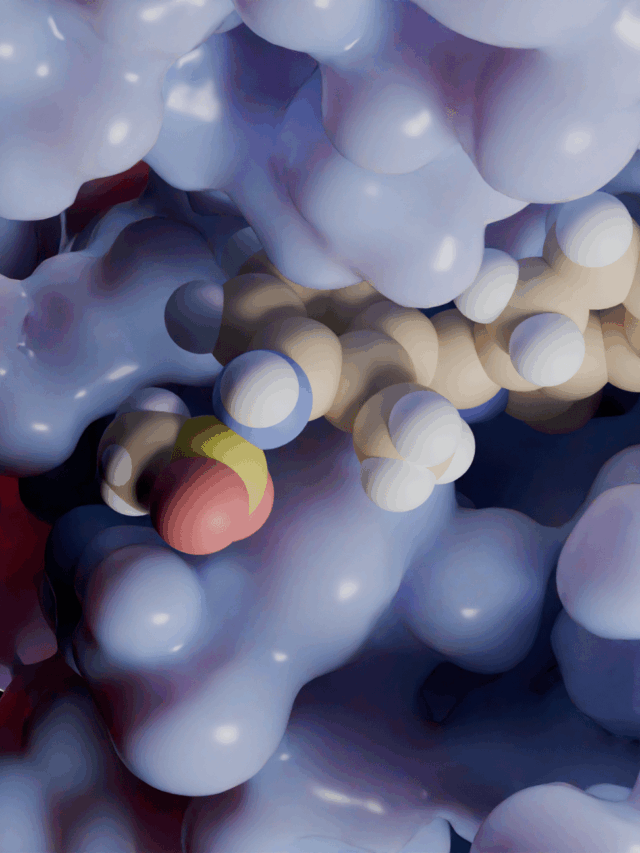ST3Gal-I Sialiltransferaz: Kristal Yapı ve MD Simülasyon ÖngörüleriST3Gal-I Sialiltransferaz: Kristal Yapı ve MD Simülasyon Öngörüleri
Recommended for you
Glukozidaz Enziminin Allosterik İnhibisyonunda Substratın Aktif Bölgeden Çıkarılması
Bir Bromodomain İnhibitörü ile Sıtma İlacını Keşfetmek: Bir Moleküler Dinamik Simülasyonu
Bir Bakteriyel Alarmon Enzimi – (p)ppApp Sentetaz (PDB 8VX3)
AMPK’nın Çarpıcı 4K Moleküler Dinamiği (PDB 3AQV) | Bilim Sanatla Buluşuyor
Alfa-Glukozidaz’da Allosterik İnhibisyon: 4K Hiper-Gerçekçi Moleküler Dinamik Simülasyonu
Aktif Bölgeye Gömülü Bir Ligandın Zamana Bağlı Hareketi
BBu videoda, bir memeli sialiltransferaz enzimi olan ST3Gal-I’in yapısını ve işlevini yüksek kaliteli bir moleküler dinamik (MD) simülasyonu aracılığıyla keşfediyoruz. ST3Gal-I (PDB ID: 2WNB), bir disakkarit substratına ve CMP’ye (sitidin monofosfat) bağlı olarak gösterilmekte ve enzimi bir sialik asit şekerini aktarma eyleminde etkili bir şekilde yakalamaktadır. ST3Gal-I’in glikozilasyondaki rolünü açıklıyor, sialiltransferazların nasıl çalıştığını detaylandırıyor ve MD simülasyonunun enzimin dinamik davranışı hakkında ortaya koyduklarını vurguluyoruz.
Glikozilasyonda ST3Gal-I
Sialik asitle sonlanan glikanlar birçok memeli hücre yüzeyi proteinini ve lipidini süsleyerek hücre tanıma, yapışma ve bağışıklık yanıtı gibi süreçleri etkiler. Sialiltransferaz enzimleri (ST’ler) sialik asitlerin glikanlara eklenmesini katalize eder. ST3Gal-I, glikoproteinler üzerindeki çekirdek 1 O-glikanın (Galβ1-3GalNAc) galaktozuna spesifik olarak sialik asit ekleyen bir β-galaktosid α2,3-sialiltransferazdır. ST3Gal-I, glikanları sialik asit ile kaplayarak glikan zincirlerinin sonlandırılmasına ve biyolojik sinyalizasyonun modüle edilmesine yardımcı olur. Özellikle, ST3Gal-I aktivitesindeki değişiklikler hücre yüzeyi glikozilasyonunu değiştirebilir; örneğin, ST3Gal-I bazı kanserlerde aşırı eksprese edilir ve tümör hücrelerinin anormal sialilasyonuna yol açar.
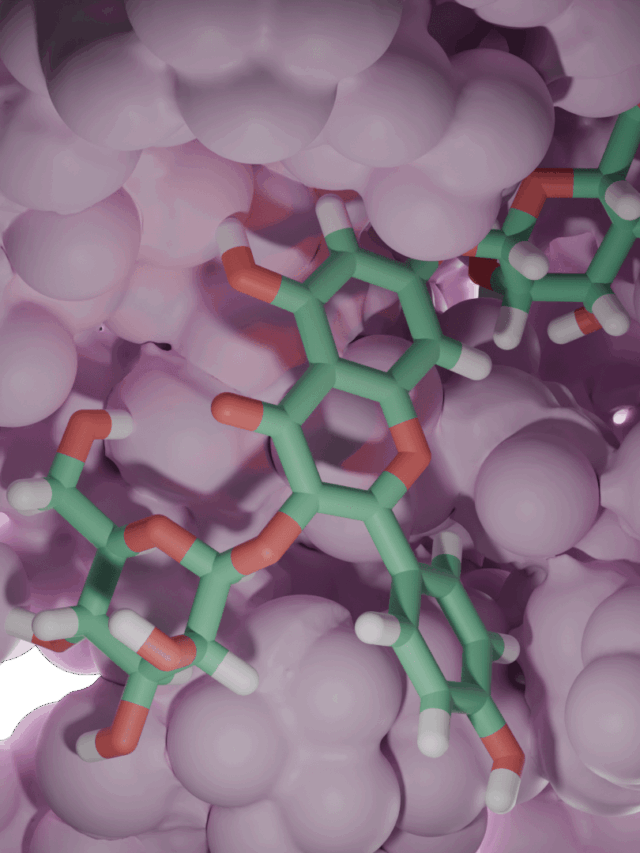
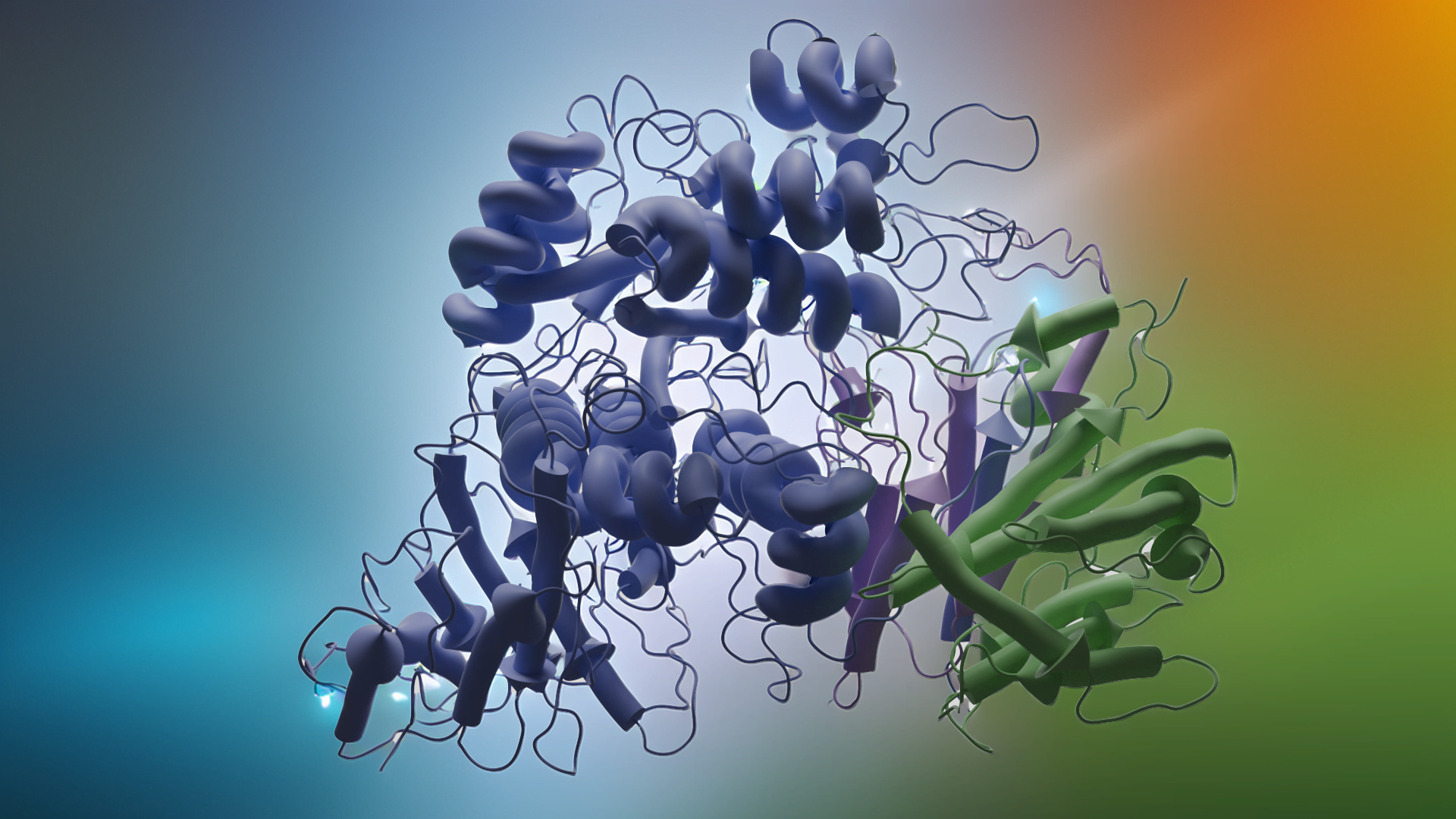
Kristal Yapı (PDB 2WNB)
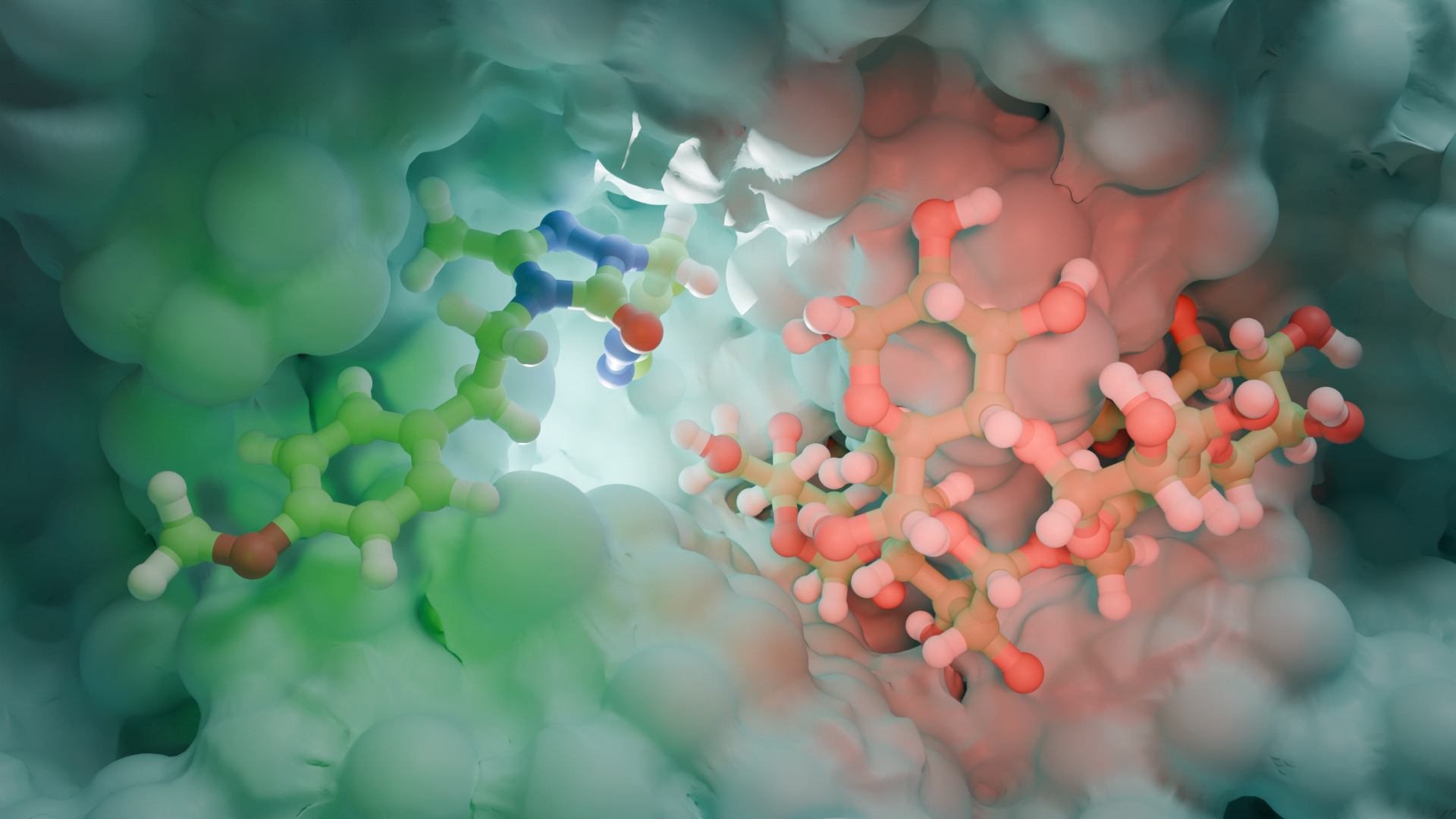
Domuz ST3Gal-I’in (PDB 2WNB) yüksek çözünürlüklü kristal yapısı, enzimin substratlarını nasıl bağladığını ortaya koymaktadır. Çözülen ilk memeli sialiltransferaz yapısı olan bu yapıda ST3Gal-I, bir disakkarit alıcı analogu ve CMP (donörden ayrılan nükleotit grubu) ile birlikte kristalize edilmiştir. Aktif bölge, sialik asit transferi için konumlandırılmış bir cepte yuvalanmış disakkariti gösterirken, CMP donör bağlanma bölgesinde oturur. Enzimdeki korunmuş dizi motifleri (sialilmotifler olarak adlandırılır) şekeri ve nükleotidi kavrayarak kataliz için uygun hizalamayı sağlar. Bu yapısal anlık görüntü, enzimin özgüllüğünü ve mekanizmasını anlamak için bir temel sağlar ve hatta seçici sialiltransferaz inhibitörlerinin tasarımına rehberlik eder.
Katalitik Mekanizma
ST3Gal-I, sialiltransferazlar için ortak olan SN2 benzeri bir mekanizma ile çalışır. Tersine dönen bir glikoziltransferazdır, yani reaksiyon sırasında şeker bağlantısının yönü değişir. Katalitik döngüde, alıcının hidroksil grubu donör sialik asidin anomerik karbonuna saldırır. Katalitik bir baz (ST3Gal-I’in aktif bölgesindeki bir histidin) aynı anda alıcının OH’sini deprotonize ederek reaksiyonu kolaylaştırır. Bu tek adımlı nükleofilik saldırı, ayrılan grubun (CMP) karşı yüzden ayrılmasına neden olarak alıcı üzerinde bir α2,3 sialik asit bağı oluşturur. Birçok glikoziltransferazın aksine, sialiltransferazlar aktivite için bir metal iyonu kofaktörü gerektirmez. 2WNB yapısı, enzimi hem ürün (CMP) hem de alıcı bağlıyken yakalar, esasen reaksiyonun sonunda donar ve bu SN2 mekanizmasının temel yönlerini doğrular.
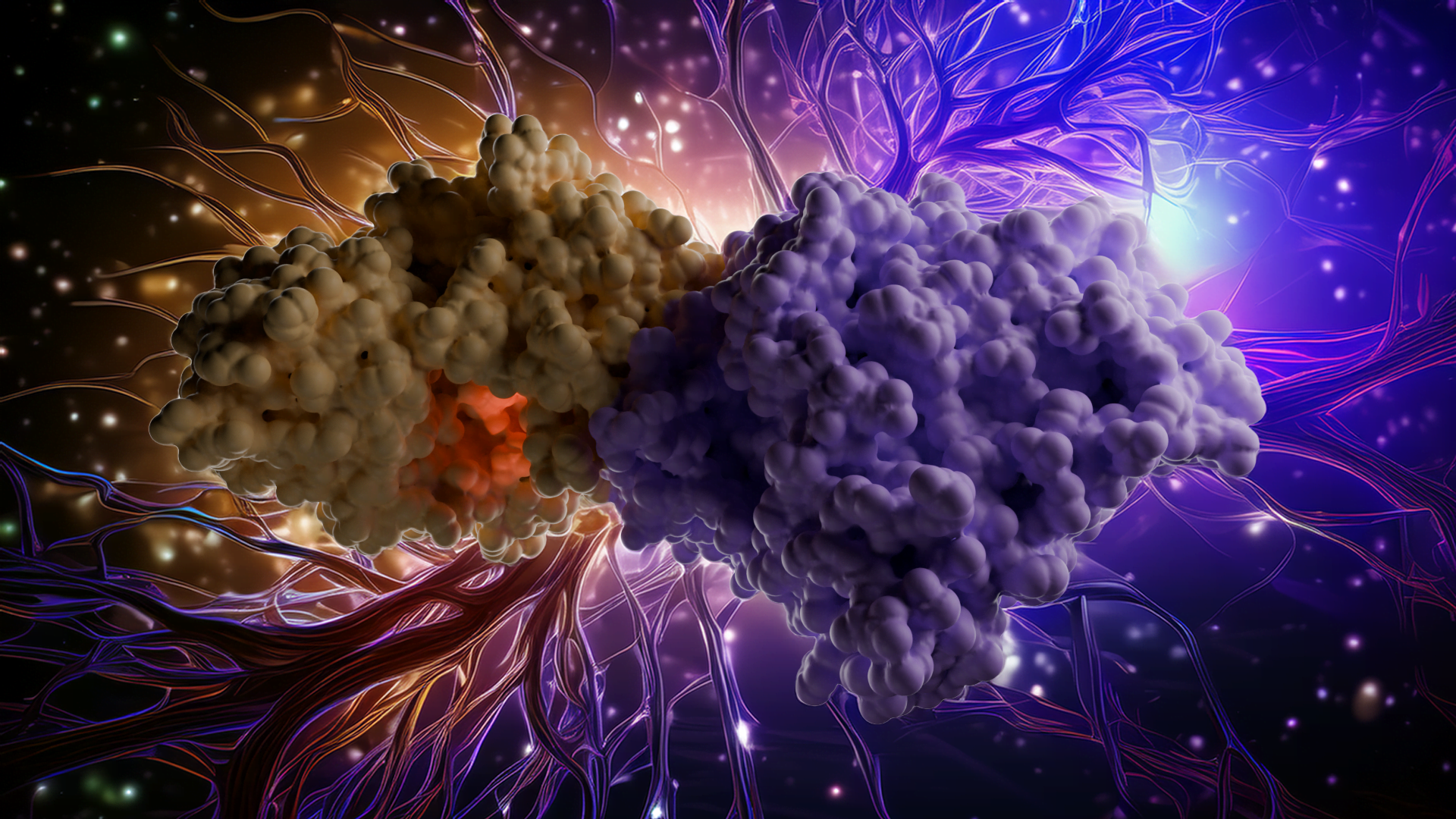
Moleküler Dinamik Simülasyon
Bu videonun en önemli özelliklerinden biri ST3Gal-I’in işlevini canlandıran MD simülasyonudur. Enzimi çözünmüş bir ortamda simüle ederek, doğal hareketlerini ve bağlı ligandları gerçek zamanlı olarak nasıl barındırdığını gözlemleyebiliyoruz. Özellikle simülasyon, aktif bölge döngülerinin substrat bağlanmasına izin vermek için açıldığını, ardından kataliz sırasında disakkarit ve CMP etrafında kapandığını göstermektedir. Bu esnekliğe rağmen, enzim ve şeker arasındaki temel temaslar bozulmadan kalmakta ve reaksiyon için gereken hassas hizalamayı korumaktadır. Ayrıca katalitik histidinin substrata doğru pozisyon değiştirerek proton transferindeki rolünü güçlendirdiğini gözlemliyoruz. Bu dinamik bilgiler statik kristal yapıyı tamamlayarak ST3Gal-I’in mekanizmasının daha eksiksiz bir resmini ortaya koymaktadır.
Önemi
Bu video, yapısal verileri ve MD simülasyonunu entegre ederek, yöntemleri birleştirmenin biyomoleküler işlev anlayışımızı nasıl geliştirdiğinin altını çiziyor. ST3Gal-I’i hareket halinde görselleştirmek, hem bilim insanlarının hem de öğrencilerin enzimin mekanizmasını statik bir anlık görüntünün ötesinde takdir etmelerine yardımcı olur. Bu tür bilgiler sadece akademik açıdan ilginç olmakla kalmaz, aynı zamanda pratik etkileri de vardır. Örneğin, ST3Gal-I’in nasıl bağlandığını ve esnediğini bilmek, potansiyel olarak kanser tedavisi veya anti-enflamatuar tasarımla ilgili olan sialilasyonu modüle etmeyi amaçlayan ilaç keşif çabalarına yardımcı olabilir. Genel olarak, ST3Gal-I’in yapısı ve dinamiklerinin ayrıntılı görünümü, glikozilasyon ve yaşamın sofistike moleküler mekanizması hakkındaki anlayışımızı zenginleştirmektedir.
Referanslar
- Structure-Function Analysis of the Human Sialyltransferase ST3Gal I
Jeanneau, Charlotte et al. Journal of Biological Chemistry, Volume 279, Issue 14, 13461 – 13468 https://doi.org/10.1074/jbc.M311764200 - https://doi.org/10.1016/S0300-9084(01)01301-3
- The ST3Gal-I Sialyltransferase Controls CD8+ T Lymphocyte Homeostasis by Modulating O-Glycan Biosynthesis Priatel, John J et al. Immunity, Volume 12, Issue 3, 273 – 283 https://doi.org/10.1016/S1074-7613(00)80180-6