I–VII olarak adlandırılan ve her biri bir çinko-hidroksit mekanizmasıyla karbon dioksitin (H2O + CO2 ⇄ HCO3− + H+) geri dönüşümlü hidrasyonunu katalize eden yedi genetik olarak farklı memeli karbonik anhidraz izozimleri vardır. İnsan izozim I , insan izozim II , sığır izozim III ve murin izozim V’nin üç boyutlu yapıları, bir β-tabaka üst yapısının hakim olduğu ortak bir kıvrım ortaya koymaktadır. Bilinen yapıya sahip her bir memeli izoziminde, katalitik olarak zorunlu çinko iyonu, 15-A derinliğinde, konik aktif bölge yarığının altındaki β-tabakasının bir yüzünde bulunur. Çinko, His-94, His-96, His-119 ve tetrahedral geometrili hidroksit iyonu ile ligandlanır; Thr-199, çinkoya bağlı hidroksit iyonundan bir hidrojen bağını kabul eder. Genel yapısal homolojiye rağmen, izozim I, II, III ve V’nin aktif bölgelerindeki lokal yapısal farklılıklar, katalitik aktivitede 103 kat farklılıklara yol açar. Bu izozimlerden insan karbonik anhidraz II (CA II) şu anda enzimolojik ve x-ışını kristalografik yöntemlerle kapsamlı şekilde karakterize edilmiştir.
Yalnızca bir memeli karbonik anhidraz izoziminin zarla ilişkili olduğu bilinmektedir ve bu izozim, karbonik anhidraz 4 (CA IV) olarak adlandırılır. CA II gibi, CA IV de CO2 hidrasyon reaksiyonunu difüzyon kontrolünün hızına yakın bir hızda katalize eden yüksek aktiviteli bir izozimdir. İnsan böbreğinden izole edilen ve saflaştırılan doğal CA IV, translasyon sonrası bölünen ve C ucunda bir glikosilfosfatidilinositol (GPI) kuyruğu, ortak bir zar sabitleme motifi ile modifiye edilmiş, glikosile edilmemiş bir 35-kDa proteindir. CA IV izozimi, %5 sodyum dodesil sülfat (SDS) içinde çözündürüldüğünde dikkate değer stabilitesine katkıda bulunan iki disülfid bağı içerir. İnsan CA IV için tam uzunluktaki cDNA, bir Agt10 böbrek cDNA kitaplığından izole edilmiştir ve COS hücrelerinde ifade edilmiştir. Çıkarsanan amino asit dizisi, 18 kalıntılı bir sinyal dizisini, diğer insan karbonik anhidraz izozimleriyle %30-36 dizi özdeşliği sergileyen 260 kalıntılı bir segmenti ve C terminalinde 21 kalıntılı bir hidrofobik alan içeren ek bir 27 kalıntılı segmenti içerir. C-terminal alanı muhtemelen CA IV’ün membran ile ilişkisini belirtir ve çeviri sonrası bölünme ve GPI çapasına transfer için bir sinyal içerir. C-terminal alanının çıkarılması, GPI bağlantılı CA IV ile aynı katalitik özelliklere sahip tamamen aktif, çözünür, salgılayıcı bir CA IV formuyla sonuçlanır.
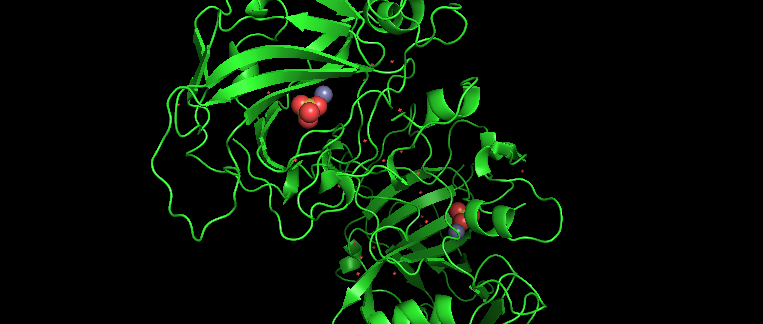
Karbonik Anhidraz 4
Hem karbonik anhidraz 4 hem de karbonik anhidraz 2 insan böbreğinin işlevinde önemli roller oynar ve nefrondaki hücresel konumları oldukça farklıdır. Sitozolik izozim CA II, proksimal ve distal üriner asitleşmeye katıldığı renal tübüllerin ve toplama kanallarının belirli hücrelerinde bulunur. Membran bağlantılı izozim CA IV, nefronun iki segmentinde fırça sınırının apikal plazma membranlarında bulunur: proksimal kıvrımlı tübül ve Henle’nin kalın çıkan kolu. Karbonik anhidraz 4 izozimi, lümendeki denge pH’ını modüle etmede rol oynar ve lümenden bikarbonat geri emiliminde baskın bir rol oynar. CA IV’ün proksimal tübülün bazolaterial plazma membranlarında ve çıkan kalın uzuvda tanımlanması da bu izozimin bikarbonat plazma taşınmasında bir rolü olduğunu düşündürür.
Karbonik anhidraz 4 izozimi pulmoner endotel hücrelerinin lümen yüzeyinde de lokalizedir. Burada CA IV, CO2 vermek üzere serum bikarbonatın dehidrasyonunu katalize etme işlevi görür, CO2 daha sonra kapiller endotel yüzeyi boyunca kolayca difüze olur ve ekspirasyondan sonra akciğerden dışarı çıkar. Akciğer ve böbrekten izole edilen ve saflaştırılan karbonik anhidraz 4 proteinleri esasen aynı enzimlerdir. İlginç bir şekilde, CA IV aynı zamanda bir oküler kapiller yatağın endotel hücrelerinde de bulunur, koriocapillaris, bu izozimin CA II’ye ek olarak göz içi basıncını düzenlemek için kullanılan CA inhibitörlerinin farmasötik bir hedefi olduğunu gösterir. Karbonik anhidraz ve kanser hakkında daha fazla bilgi almak için: Moleküler Docking ve Kanser Tedavisinde İlaç Keşfi yazısını okuyabilirsiniz. Moleküler docking ve moleküler dinamik konuları hakkında daha fazla bilgiye de linklerden ulaşabilirsiniz.
Kaynak: Travis Stams, Satish K. Nair, Torayuki Okuyama, Abdul Waheed, William S. Sly, and David W. Christianson
PNAS November 26, 1996 93 (24) 13589-13594; https://doi.org/10.1073/pnas.93.24.13589