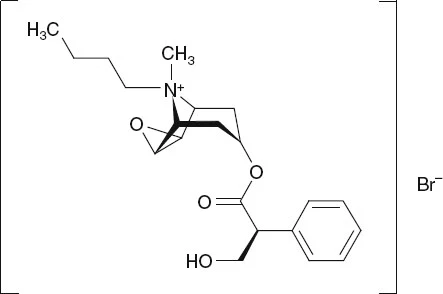
Sindirim sistemi ilaçları önemli sindirim sistemi hastalılarının tedavisinde ve kanser türlerinin tedavisinde sıklıkla kullanılır. Kanser önemli bir halk sağlığı ve ekonomik sorunu temsil eder ve dünya çapında önde gelen ölüm nedenidir. Her iki cinsiyetin birleşimi için, akciğer ve meme kanseri en sık teşhis edilen kanserlerdir (toplam vakaların her birinin %11,6’sını oluşturur) ve kanser ölümlerinin önde gelen nedenleridir (sırasıyla toplam kanser ölümlerinin %18,4 ve %6,6’sı) [kaynak]. Bununla birlikte, sindirim sistemi ilaçları kanserleri, bir araya getirildiklerinde, diğer herhangi bir organda ortaya çıkan kanserlerden daha fazla yeni vaka ve ölüme neden olmaktadır [kaynak]. 2018 yılında tüm sindirim sistemi kanserleri arasında kolorektal kanserin (KRK) hem yeni tanı konmuş en fazla vakaya sahip olduğu hem de en fazla ölüme neden olduğu tahmin edilerek onu mide ve karaciğer kanseri izlemiştir [kaynak]. Solid tümörlerin günümüzdeki tedavisi cerrahi olarak çıkarılmasına odaklanmaktadır, ancak bu seçenek genellikle kanser gelişiminin sadece erken aşamalarında mevcuttur [kaynak]. Daha sonraki aşamalarda, metastazlar tespit edildiğinde, tercih edilen tedavi kemoterapidir. Ne yazık ki, pek çok hasta ya tedavinin başlangıcından itibaren ya da tedavi süresince kemoterapi direnci yaşar ve sonuçta terapi başarısızlığı ile sonuçlanır [kaynak]. Bu sorunlar, diğer terapötik seçeneklere olan ihtiyacı yaratır ve yeni kimyasalların keşfinin peşinden gitmeye zorlar.
Bununla birlikte, herhangi bir ilacın geliştirilmesine giden yol aşırı uzun, zahmetli ve maliyetli olduğundan, yeni terapötiklerin geliştirilmesi ilaç şirketleri için giderek daha zor hale geldi. Bu konu ile ilgili daha fazla bilgi için İlaçlar Nasıl Keşfedilir – Antiviral İlaçları Hızla Nasıl Keşfedilir adlı yazıyı okuyabilirsiniz. Günümüzde yeni bir ilacın geliştirilmesi yaklaşık 10-15 yıl sürmektedir ve tüm çabalara rağmen başarı oranı çok düşük kalmaktadır (yaklaşık % 2). Son yıllarda, yeni keşfedilen ve Gıda ve İlaç Dairesi (FDA) onaylı ilaçların havuzu, çoğunlukla klinik araştırmaların artan maliyeti nedeniyle azalmaktadır. 2004’ten 2012’ye kadar, bir farmasötik klinik denemenin medyan toplam maliyetinin 2-3 milyar ABD doları civarında olduğu tahmin ediliyordu, ancak enflasyona göre ayarlandığında finansman için gereken para şimdiye kadar daha da yüksek olacaktı. Bu verilere sindirim sistemi ilaçları da dahildir ve ilaç geliştirmek oldukça maliyetlidir. Yatırım yapılan her bir dolar için bir dolardan daha azının kâr olarak geri döndüğü ve böylece yeni ilaçların geliştirilmesini çoğu şirket için riskli ve istenmeyen bir süreç haline getirdiği tahmin edilmektedir. Bu dezavantajlar göz önüne alındığında, ilaç araştırmalarını daha az zaman alıcı ve mali açıdan talepkar hale getirmek için ilaç geliştirmeye yönelik yeni yaklaşımlar kullanılmalıdır. İlaç yeniden konumlandırma bu yaklaşımlardan sadece bire tanesidir. Sindirim sistemi ilaçları için de bu yaklaşım benimsenme aşamasındadır.
Bu tür bir yaklaşım, ilacın yeniden konumlandırılmasıdır (ilaç yeniden kullanım olarak da adlandırılır); yani, orijinal tıbbi endikasyon kapsamı dışında kalan onaylanmış veya araştırma aşamasındaki ilaçlar için yeni kullanımları belirleme stratejisidir.
İlaç yeniden konumlandırma, yeni terapötik ajanların geliştirilmesine göre bir takım avantajlar sunar. Bu avantajlar sindirim sistemi ilaçlarının belirlenmesinde önemli bir yere sahiptir. Belirtildiği gibi, bir avantaj, yeni bir ilacın geleneksel olarak geliştirilmesine kıyasla daha düşük maliyette yatmaktadır. Gerçekten de, ilaç endüstrisinde yeni bir ilacı tasarlamak, test etmek ve uygulamak için gereken tüm adımlar ve denemeler 13 milyar dolara kadar ulaşabilirken [10], ilacın yeniden konumlandırılması çok daha uygun bir maliyet sunar (yeniden tasarlanmış bir ilacı pazara sunmak) ortalama 300 milyon ABD dolarına mal olduğu tahmin edilmektedir). Bununla birlikte, maliyet tasarrufu tahminlerinin oldukça farklı olduğu belirtilmelidir. Örneğin, başka bir kaynak, maliyet düşüşünün %50-60 civarında olduğunu tahmin etmektedir. Daha da önemlisi, onayın olası bir tedaviye dönüştürülmesi için gereken süre çok daha kısadır, çünkü yeniden konumlandırma potansiyeli olan eski ilaçlar hem klinik deneyleri hem de FDA onayını çoktan geçmiştir. Bu, yalnızca tüm sürecin hızlandırılmasıyla değil, aynı zamanda yeni bir ilaca kıyasla daha yüksek öngörülen güvenlikle de sonuçlanır.
Sindirim Sistemi İlaçları Nelerdir?
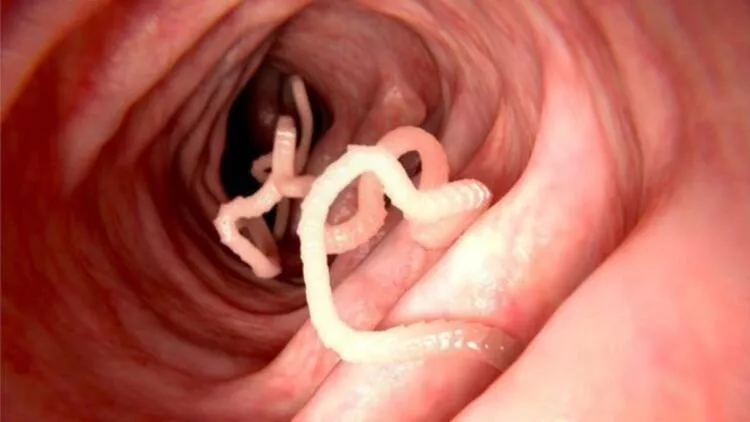
Benzimidazoller, önemli antelmintik ilaçları (örneğin, mebendazol, albendazol, tiyabendazol, fenbendazol, triklabendazol, flubendazol) içeren bir grup heterosiklik aromatik organik bileşiklerdir. Son birkaç yılda, bazıları gastrointestinal, karaciğer ve pankreas kanserlerinin tedavisi için başarıyla test edilmiştir. Sindirim sistemi ilaçları olukça fazladır bunlardan bazıları şunlardır:
Mebendazol
Mebendazol (MBZ), parazitik solucan gruplarını (örneğin, yuvarlak solucanlar, kancalı kurtlar ve kıl kurdu) tedavi etmek için yaygın olarak kullanılan bir antelmintik ilaçtır. Sindirim sistemi ilaçları arasındaki yerini almıştır.
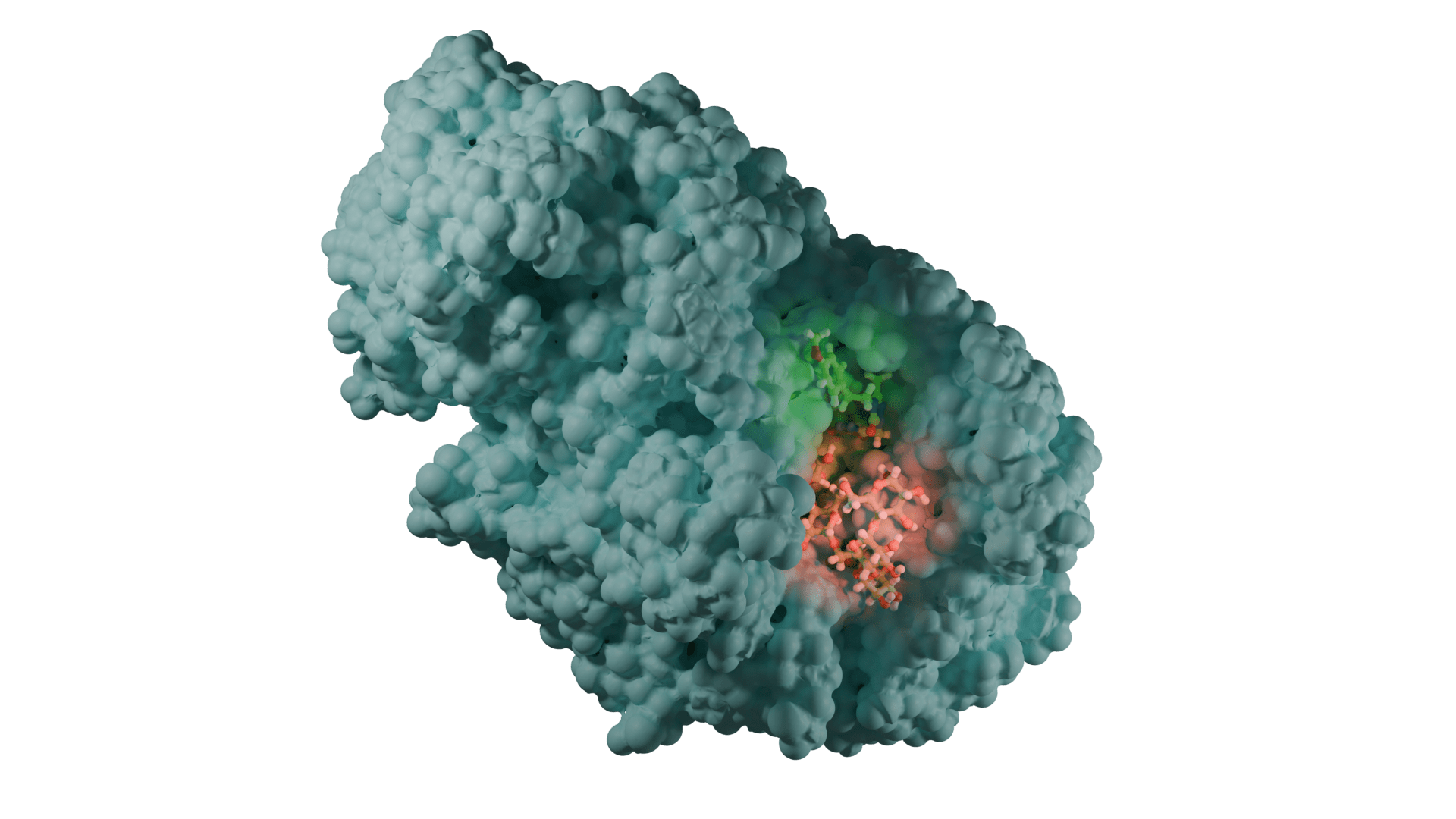
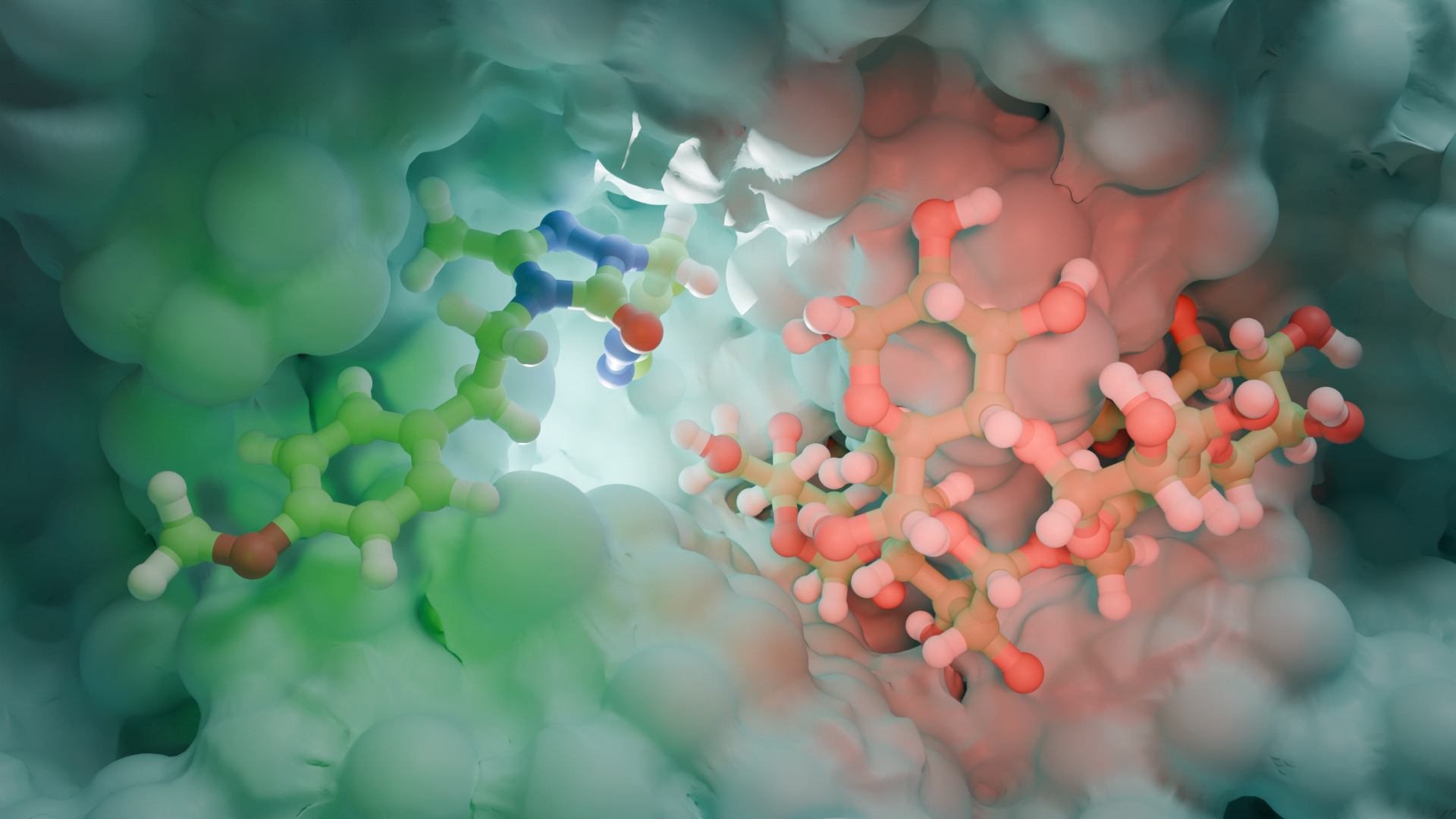
Özellikle, tübülin polimerizasyonunu bloke ederek MBZ, helmintlerin bağırsak hücrelerinde mikrotübül fonksiyonunu ve sonuç olarak besin alımını tehlikeye atabilir. MBZ’nin gastrointestinal kanserlerin tedavisi için anti-kanser özellikleri, son on yılda yoğun bir şekilde incelenmiştir. Örneğin, MBZ’nin, ister tek başına (0.15-20 μM) ister kemoterapötik ilaç 5-florourasil (5-FU) ile kombinasyon halinde kullanılsın, hücre büyümesini ve birincil mide tümöründen türetilen bir insan malign asit hücre hattının istilasını engellediği görüldü. Ayrıca, MBZ tedavisi beş CRC hücre hattında (IC50 < 5 μM) başarılı bir şekilde test edilirken, malign olmayan fenotipli üç hücre hattına karşı sitotoksik aktivite göstermedi. In vivo, MBZ anti-kanser etkinliği, Adenomatous polipozis koli (Apc) geninde yapısal bir mutasyon taşıyan fareler (Apcmin/+ fareler kullanılarak, ailesel adenomatöz polipoz (FAP) modelinde test edildi. 35 mg/kg) steroid olmayan antiinflamatuar ilaç sulindac ile kombinasyon halinde kullanıldığında bağırsak mikroadenomlarının sayısını ve boyutunu azaltmıştır.Mekanik olarak, bu iki ilaç hem MYC hem de COX2 yolaklarını ve anjiyogenezi ve pro-tümörijenik sitokinlerin salınımı. Özellikle, Nyger ve Larsson tarafından bir vaka raporunda, MBZ, dirençli metastatik kolon kanserli bir hastada akciğer ve lenf nodu metastazlarının remisyonunu ve karaciğer metastazlarının kısmi remisyonunu indüklemiştir.
Albendazol
Albendazol (ABZ), giardiasis, ascariasis, trichuriasis ve filariasis gibi çeşitli paraziter enfeksiyonların tedavisinde antelmintik ilaç olarak kullanılan bir diğer önemli benzimidazol bileşiğidir. ABZ’nin etki mekanizması, solucanların bağırsak hücrelerinde mikrotübül polimerizasyonunu etkileyebildiği için MBZ’ye benzer özellikler gösterir. Sindirim sistemi ilaçları arasında yerini almıştır.
Flubendazol
Potansiyel anti-kanser aktivitesine sahip başka bir benzimidazol bileşiği flubendazoldür (FLU). Gastrointestinal nematod enfeksiyonlarıyla mücadele etme yeteneğine ek olarak, FLU’nun (0.1-10 μMol/L) CRC hücre büyümesini inhibe ettiği ve ABZ’ye benzer şekilde Paklitaksel ile sinerji oluşturduğu bildirilmiştir. Daha ileri çalışmalar, FLU’nun (1 uM), siklin B1 ve siklin D1 seviyelerini değiştirerek CRC hücre hatları SW480 ve SW620 üzerinde anti-mitojenik etkisini uyguladığını ortaya koydu. Aynı hücrelerde, FLU apoptozu ve erken yaşlanmayı ve çeşitli yapışma belirteçlerinin (ICAM-1; αE-katenin; β-katenin; integrin α5 ve β1) ekspresyonlarını azaltarak hücre yapışmasını bozdu. Ek olarak, FLU, aktivasyonu transforme hücrelerde hücre proliferasyonunu, hayatta kalmasını ve metastatik potansiyelini modüle eden bir transkripsiyon faktörü olan nükleer faktör-kappa B’nin (NF-κB) fosforilasyonunu/aktivitesini olumsuz etkilemiştir. FLU ayrıca metastatik belirteçlerin (ICAM-1, EpCAM, integrin α5, β1, α-tubulin) ekspresyonunu da baskılayarak hücre göçünü bloke etti. Bununla birlikte, umut verici deneysel kanıtlara rağmen, şimdiye kadar FLU kullanan hiçbir klinik çalışma yapılmamıştır. Sindirim sistemi ilaçları arasındaki yerini almıştır.
Halojenli Salisilanilidler
Halojenli salisilanilidler, bağırsak tenyası ve parazit enfeksiyonlarını tedavi etmek için yaygın olarak kullanılan bir grup antelmintik ilaçtır. Bu bileşikler bir salisilik asit halkası ve bir anilid halkasından oluşur ve niclosamid, rafoxanide ve closantel gibi çok çeşitli ilaçları içerir.
Niklosamid
Niklosamid, tenya enfeksiyonlarının tedavisi için Gıda ve İlaç Dairesi (FDA) onaylı bir ilaçtır ve etki mekanizması oksidatif fosforilasyonun ayrılmasından oluşur. Son on yılda, niklosamid, bu ilacın önemli onkojenik yolakların güçlü bir inhibitörü olduğunu gösteren çok sayıda kanıt nedeniyle bilim camiasının ilgisini kazanmıştır.
Özellikle, niklosamidin (0.4, 2 ve 10 μMol/L), anormal aktivasyonu sporadik CRC’lerin yaklaşık %80’inde [65] meydana gelen Wnt/β-katenin sinyal yolunu ve insan CRC hücre hatlarının proliferasyonunu inhibe ettiği rapor edilmiştir. HCT-116, HT-29 ve Caco2, anahtar düzenleyici APC’deki mutasyonlardan bağımsız olarak. Azalan β-katenin sinyali, niklosamidin Wnt yolu bileşeni darmadağınık-2’nin (Dvl2) ekspresyonunu aşağı regüle etme yeteneğiyle bağlantılıydı. Ayrıca, metastatik hastalığı olan hastaların karaciğerlerinden cerrahi rezeksiyon ile izole edilen primer CRC hücrelerinde ve insan CRC ksenograftları implante edilmiş NOD/SCID farelerinde (200 mg/kg’da kullanıldığında) niklosamid aracılı anti-kanser etkileri görülmüştür. Son zamanlarda, Wang ve meslektaşları tarafından yapılan zarif çalışmalar, Wnt/β-katenin kaskadının Niklosamid tarafından (0.04-10 μM’de kullanılır) inhibisyonuna otofajinin indüklenmesinin aracılık ettiğini gösterdi.
Rafoksanid
Bir başka halojenli salisilanilid olan rafoxanide, fascioliasis ve bazı gastrointestinal yuvarlak solucanların veteriner tedavisi için FDA tarafından onaylanmıştır. İnsanlarda Rafoxanide kullanımına ilişkin kanıtlar yetersiz olsa da, bir çalışma, fascioliasis’ten etkilenen yedi yaşındaki bir kız çocuğunda ilacın terapötik kullanımını bildirmiştir. Rafoxanide, niclosamide kıyasla belirgin şekilde daha düşük hemolitik aktivite gösterdi ve yaygın olarak melanomlarda ve CRC’lerde bulunan ve hastalar için daha kötü bir prognozla ilişkili olan onkojenik BRAF V600E mutant proteininin güçlü bir inhibitörü olduğu bildirildi. Grubumuzdan CRC’de yapılan son çalışmalar, rafoxanide’nin (1.25-5 μM) insan CRC hücrelerinin büyümesini sınırladığını gösterdi – hem mutasyona uğramış V600E (HT-29) hem de vahşi tip BRAF alellerini (HCT-116 ve DLD-1) — ancak normal kolonik epitel hücrelerininki değil. Rafoxanide’nin anti-mitojenik yeteneği, CRC hücrelerinde ER stresinin seçici indüksiyonuna dayanıyordu ve siklin D1 proteini aşağı regülasyonu, G0/G1 fazında hücre birikmesi ve ardından kaspaz bağımlı apoptoz ile ilişkiliydi. Bu gözlemler ayrıca ex vivo insan CRC eksplantlarında da doğrulanmıştır. Ek olarak, insan sporadik CRC’sini taklit eden bir model olan kanserojen azoksimetan ile tedavi edilen Apcmin/+ fareleri kullanarak rafoxanide’nin bağırsak tümörü gelişimini in vivo olarak inhibe etme kabiliyetini test ettik. Rafoxanide (7.5 mg/kg), Apcmin/+ farelere sistemik olarak uygulandığında kolon karsinojenezini durdurdu ve tedavi edilen hayvanlarda neoplastik lezyonların sayısında ve boyutunda azalmaya yol açtı. Özellikle, rafoxanide iyi tolere edilmiş görünüyordu, çünkü ilaçla tedavi edilen farelerde plasebo ile karşılaştırıldığında vücut ağırlığında önemli bir değişiklik gözlenmedi. Daha yakın zamanlarda, takip çalışmalarımız Rafoxanide’i CRC hücrelerinde gerçek bir immünojenik hücre ölümü (ICD) indükleyicisi olarak gösterdi. Ayrıntılı olarak, HCT-116 ve DLD1 CRC hücrelerinde, rafoxanide (1.25–5 μM) otofajiyi ve hasarla ilişkili tüm ana moleküler patterleri (DAMP’ler) (ekto-kalretikülin maruziyeti, adenosin trifosfat (ATP)/yüksek hareketlilik grubu kutusu 1 indükledi) (HMGB1) sürümü) ICD için gereklidir. İn vivo olarak, rafoxanide, canlı hücrelerle yeniden mücadele edilmeden önce, bağışıklığı yeterli farelerin rafoksanid ile tedavi edilen singeneik ölmekte olan tümör hücreleri ile bağışıklaştırıldığı bir aşılama deneyinde, sahte ile karşılaştırıldığında tümör büyümesini önemli ölçüde azaltmıştır. Rafoxanide’nin kanser karşıtı etkileri, yukarıda bildirilenlere benzer şekilde, mide kanserinde tanımlanmıştır [43]. Gerçekten de, Rafoxanide, hücre döngüsünün G0/G1 fazında mide kanseri hücrelerinin çoğalmasını durdurdu ve hem in vitro (12.5–100 μM) hem de in vivo (20 mg) PI3K/Akt yolunun inhibisyonu yoluyla otofaji ve apoptozu indükledi. /kilogram). Olan veriler ile sindirim sistemi ilaçları arasındaki yerini alan başka bir ilaç bileşenidir.
Closantel
Closantel, BRAF V600E’yi inhibe ettiği bildirilen başka bir sindirim sistemi ilaçları grubunda olan halojenli salisilamid ajanıdır. Closantel (0.025–10 µM), zebra balıklarında anti-anjiyojenik ve anti-tümör özellikler gösterdi ve karaciğer ve pankreas kanseri hücreleri de dahil olmak üzere insan tümör hücreleriyle ksenonakli yapılan zebra balıklarında hücre proliferasyonunu önemli ölçüde inhibe etti. Bununla birlikte, closantel’in kanser karşıtı etkilerini doğrulamak ve olası klinik uygulaması hakkında yeni ipuçları sağlamak için deneysel ve klinik öncesi modellerde daha fazla çalışmaya ihtiyaç vardır.
Levamizol
Levamizol, yuvarlak solucanın sinir sistemini hedef alan ve nikotinik asetilkolin reseptör agonisti olarak hareket ederek parazitin kaslarını felç eden imidazotiyazol ailesine aittir. Levamizol, özellikle depresif immün deneklerde doğuştan gelen ve adaptif immün yanıtları teşvik etme yeteneğinden dolayı immünomodülatör özellikleri nedeniyle ilgi çekmiştir. İlaç ayrıca, 1990’ların başında, esas olarak 5-FU gibi standart sitotoksik ajanlara yardımcı bir ajan olarak kullanıldığında, CRC tedavisi için bir anti-kanser ajanı olarak önerildi. Bununla birlikte, kanser hücresi proliferasyonunu ve/veya sağkalımını doğrudan etkilemediği için levamizol monoterapisi hiçbir zaman düşünülmemiştir. Levamizol birkaç klinik çalışmada test edilmiştir. İlk büyük ölçekli çalışma 1990’daki Intergroup çalışmasıydı (INT-0035), burada evre III CRC’li hastalar 12 ay boyunca levamizol ile tedavili veya tedavisiz ameliyat edildi veya cerrahi artı 12 ay boyunca 5-FU artı levamizol ile tedavi. Sonuçlar, kombine tedavi alan hastalarda nüks ve ölüm oranlarında önemli bir azalma olduğunu gösterdi [60]. Bununla birlikte, bu umut verici veriler, 5-FU artı levamizol ile 6 aylık tedavinin, 5-FU artı lökovorin ile kombinasyon tedavisine kıyasla hasta sağkalımını iyileştirmediği başka bir büyük randomize çalışmada doğrulanmadı. Aynı doğrultuda Wolmark ve ark. burada 1 yıllık levamizol tedavisi, CRC hastalarında 5-FU artı lökovorin rejimine ek fayda sağlamadı.
Nitazoksanit
Nitazoksanid (NTZ), tiazolid ailesine aittir ve bağırsak parazitlerine (örneğin, Cryptosporidium parvum ve Giardia lamblia) karşı etkilidir; Helicobacter ve Clostridium kaynaklı bakteriyel enfeksiyonlar; ve viral enfeksiyonlar. NTZ, farklı kanser türlerine karşı anti-proliferatif ve pro-apoptotik aktiviteleri bildiren çok sayıda kanıt nedeniyle ve mükemmel farmakokinetik ve güvenlik profilleri nedeniyle kanser tedavisi için umut verici bir aday olarak kabul edilmektedir. CRC ile ilgili olarak, NTZ’nin (50 uM), CRC hücrelerinde glutatyon-S-transferaz P1 (GSTP1) bağımlı bir şekilde apoptozu indüklediği gösterilmiştir. HCT-116 ve HT-29’dan türetilen sferoidlerde, NTZ, AMPK yolunu aktive etti ve c-Myc, mTOR ve Wnt sinyalini klinik olarak ulaşılabilir konsantrasyonlarda (0,1-17 µmol/L) aşağı regüle etti. Bu gözlemler in vivo olarak doğrulandı, burada NTZ’nin (100 mg/kg) kemoterapötik ilaç irinotekan (40 mg/kg) ile kombine tedavisi, tek başına irinotekan ile karşılaştırıldığında bir fare ksenograft modelinde tümör büyümesini güçlü bir şekilde bastırdı.
İvermektin
Ivermektin, avermektin grubuna ait bir makrosiklik laktondur. Ivermektin, γ-aminobütirik asit (GABA) reseptörlerinin veya glutamat kapılı klorür iyon kanallarının (Glu-Cl) aktivitesini artırma yeteneğinden dolayı, veterinerlik tıbbında ve klinikte onkoserkiyaz ve lenfatik filaryaz tedavisinde yaygın olarak kullanılır. parazitin sinir-kas sinyalini bloke eder.
Prazikuantel
Parazitik yassı kurtlara karşı özellikle aktif olan bir antelmintik ilaç olan Prazikuantel, uzun süredir şistozomiyazisin tedavisi için en iyi terapötik seçeneklerden biri olarak kabul edilmektedir. Prazikuantel’in anti-parazitik etki mekanizması henüz kurulmamıştır, ancak nihai sonuç hücre içi Ca2+’yı artırmak ve kas kasılmalarını indüklemek olan Ca2+ kanallarını bloke etme yeteneğine güvenebilir. Schistosomiasis gelişiminin, özellikle Güneydoğu Asya ülkelerinde (örneğin, Tayland ve Vietnam) çiğ balık yeme alışkanlığı ile bağlantılı olduğu bilinmektedir. Son çalışmalar, ilacın tekrar tekrar uygulandığı hastalarda, tedavi edilmeyen kişilere kıyasla CCA geliştirme olasılığının daha yüksek olduğunu bildirmiştir [83]. Bununla birlikte, tekrarlayan parazit enfeksiyonunun CCA gelişimi için ana risk faktörü olduğu düşünüldüğünden, prazikuantel kolanjiokarsinogenez için doğrudan bir nedensel ajan olarak düşünülmemelidir.
Pirvinyum
Pirvinyum, hem hayvanlarda hem de insanlarda kıl kurdu enfeksiyonlarını tedavi etmek için yaygın olarak kullanılır. Birkaç pirvinyum türevi üretilmiştir ve bunların arasında, tuz pirvinyum pamoat (PP)’nin kanser hücrelerine karşı özellikle etkili olduğu görülmüştür.
2004 yılına kadar uzanan ilk çalışmalar, PP’nin (0,1 ve 1 μg/mL), glukoz yoksunluğu altında kültürlenen insan pankreas tümörü hücre dizisi PANC-1 için normal ortamda değil, aşırı derecede toksik olduğunu bulmuştur. Bu etki, glikoz açlığı gibi çeşitli streslere yanıt olarak tetiklenen hayatta kalma yanlısı bir mekanizma olan Akt fosforilasyonunun inhibisyonu ile ilişkilendirildi. PP’nin anti-tümör aktivitesi, bir hipovasküler pankreas kanseri modelinde in vivo olarak doğrulandı, burada bağışıklığı baskılanmış fareler, PANC1 hücreleri ile ksenograftlandı. PP’nin (100 ve 200 μg) oral uygulamaları, tümör büyümesini azalttı ve Akt fosforilasyonunu inhibe etti, ancak bazı tümör hücreleri hayatta kaldı, muhtemelen PP’nin toksik etkisini esas olarak glikoz açlığı sırasında göstermesi nedeniyle. Bir sonraki makalede, Yu ve ark. yukarıda bahsedilen etkilerin altında yatan olası mekanizmalara ışık tutmaktadır [54]. Yazarlar, PP’nin (0,1 ve 0,3 μM), glikoz yoksunluğu tarafından indüklenen katlanmamış protein yanıtında (UPR) yer alan iki anahtar moleküler şaperon olan GRP78 ve GRP94’ün transkripsiyonel aktivasyonunu sınırladığına dair kanıt sağladı [54]. XBP-1 ve ATF4 gibi glikoz açlığının neden olduğu diğer UPR yolakları da PP tarafından bastırılmıştır. Özellikle, ektopik GRP78 ekspresyonu, hücreleri glikoz açlığı altında PP’nin neden olduğu hücre ölümünden kısmen korumuştur [54]. HCT-116 veya pankreas kanseri hücre dizisi AsPC-1 ile nakledilen çıplak farelerde ksenograft deneyleri, monoterapi olarak PP için (oral gavaj yoluyla 10 mg/kg ve intraperitoneal olarak 0.5 mg/kg uygulanan) oldukça marjinal genel anti-tümör aktivitesi gösterdi. . Bununla birlikte, tümör büyümesini azaltmada PP etkinliği, doksorubisin ile kombinasyon tedavisi ile belirgin şekilde arttırıldı. Sindirim sistemi ilaçları arasında yeri alan başka bir ilaç bileşenidir.
Piperazin
Piperazin ilk olarak 1950’lerde bir antelmintik olarak kullanıldı ve hala çocuklarda solucan enfeksiyonlarının tedavisi için reçetesiz satılan ilaçların aktif bileşenidir. Piperazin, kas membranı GABA reseptörlerine doğrudan ve seçici olarak bağlanır ve muhtemelen sinir uçlarının hiperpolarizasyonuna neden olarak solucanın felç olmasına neden olur. Piperazinin anti-kanser etkilerini bildiren ilk çalışma, McNair ve meslektaşlarının piperazin türevlerinin bir etkisini tanımladıkları 1963 yılına dayanmaktadır: Walker 256 karsinosarkom hücreleri ile aşılanmış sıçanlarda tümör büyümesinin önlenmesi. Son kanıtlar, piperazin ve türevlerinin kanser hücreleri üzerinde önemli anti-neoplastik aktivite gösterme kabiliyetini doğrulamıştır. Örneğin, piperazin türevi AK301 (5 uM’de kullanılır), CRC hücre hatları (yani HT-29 ve HCT-116) üzerinde test edildi; tübülin polimerizasyonunu dramatik olarak bozdu ve mitotik arresti indükledi. Buna paralel olarak, AK301, tümör nekroz faktörü (TNF) reseptörü 1’in ekspresyonunu arttırdı, böylece kanser hücrelerini TNF-a tarafından apoptotik hücre ölümüne daha duyarlı hale getirdi. BK10007S olarak adlandırılan başka bir piperazin türevinin, HCC hücre hatları üzerinde anti-kanser etkileri gösterdiği rapor edilmiştir. BK10007S (0, 3, 7 ve 8.5 uM), siklin D1 ekspresyonunun azalması üzerine HepG2 ve SK-Hep1 hücre proliferasyonunu bloke etti. Ayrıca, BK10007S (7 ve 8.5 μM), kaspaz-3 ve PARP-1 protein bölünmesini teşvik ederek ve AKT ve ERK kinazların fosforilasyonunu ve survivin ve CUGBP1 proteinlerinin ekspresyonunu azaltarak apoptotik hücre ölümünü indüklemiştir. Toplu olarak, bu tür sonuçlar piperazin türevlerinin potansiyel olarak CRC ve HCC’den etkilenen hastalarda anti-kanser ajanları olarak kullanılabileceğini düşündürmektedir.
Tüm bu sindirim sistemi ilaçları belirli fonksiyonel gruplar bazında incelenmiş olup, farklı fonksiyonel grupları da bir arada içerme özelliğine sahip olabilir. Sindirim sistemi ilaçları diğer ilaç sınıflarında olduğu gibi oldukça geniş bir yelpazeye yayılmaktadır. Bu çerçevede değerlendirildiğinde ilaç keşif çalışmaları ve sindirim sistemi ilaçları yelpazesi geniş alanlara yayılmaktadır.
Menu
Biraz Müzik İyi Gider! Playlist’i Kaydet ve Odaklanmak için Spotify Hesabından Her Zaman Ulaş. Play’e Basmayı Unutma ;)
Videolara Göz At! Artık Her Şey Hareketli! Yeni Bilgiler Edin! Moleküler Dinamik Simülasyonları Bilimin Önemli Konularından.