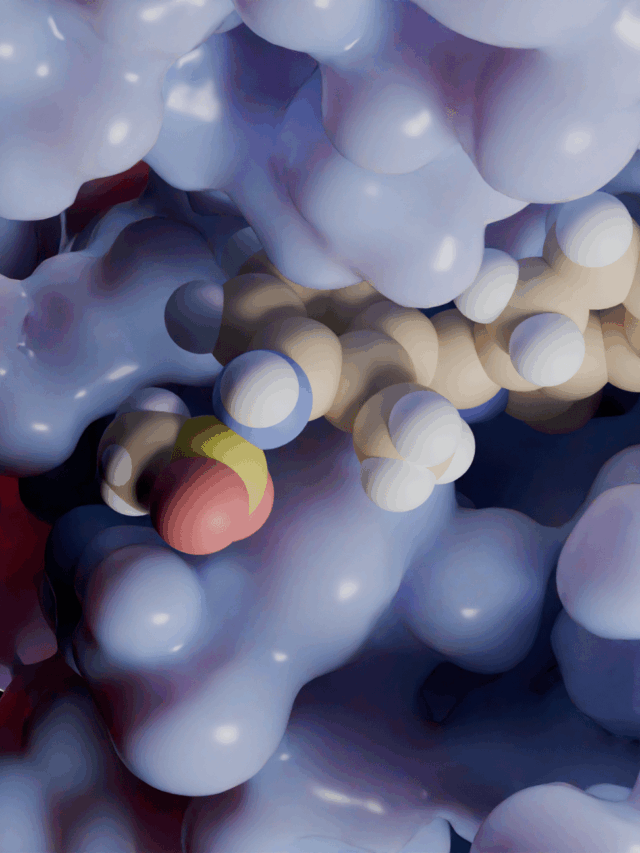Glutatyon redüktaz aktivitesi ile ilgili bu yazıdaki ligandların sentezi, yapı aydınlatması, in vitro çalışması Prof. Dr. Nurcan Karacan ve Dr. Öğr. Üyesi Turgay TUNÇ‘a aittir. Bu ligandlarla yapılan docking çalışması ve sonuçların yorumlanması Prof. Dr. Nurcan Karacan ve Ahmet B. Ortaakarsu tarafından yapılmıştır.
1. AMAÇ
Bu çalışmada, daha önceden sentezlenmiş ve in vitro glutatyon redüktaz inhibitor aktiviteleri denel olarak belirlenmiş yeni Schiff bazlarının (1-4) moleküler yerleştirme (docking) çalışmaları yapılacaktır.
In vitro çalışmalar Schiff bazlarının (4 hariç) glutatyon redüktaz (GR) enzimine karşı inhibitor olarak davrandığını göstermiştir. Schiff bazlarının inhibisyon etkileri simulasyon hesaplamaları ile analiz edilecektir. Böylece, ligandların GR enzimine bağlanma yerleri ve bağlanma afiniteleri (G skor) teorik olarak belirlenecektir.
Hesaplamalar farklı canlılardaki GR enzimleri (homo sapiens, Saccharomyces cerevisiae, Plasmodium falciparum) üzerinde tekrarlanacak, böylece yeni Schiff bazlarının canlılar üzerindeki olası etkileri öngörülebilir hale gelecektir. Sonuçlar sonraki in vitro ve in vivo çalışmaları için önemli bir zemin hazırlayacaktır.
Denel veriler 4 nolu bir Schiff bazının enzim aktivatörü olarak davrandığını göstermiştir. Bu farklılığın nedeni docking çalışmaları ile aydınlatılacaktır. Hesaplamalar ile GR enziminde allosterik merkezin yeri tam olarak belirlenmeye çalışılacaktır.
2. GLUTATYON REDÜKTAZ VE İŞLEVİ(KURAMSAL TEMELLER)
2.1 Glutatyon Redüktaz Enzimi
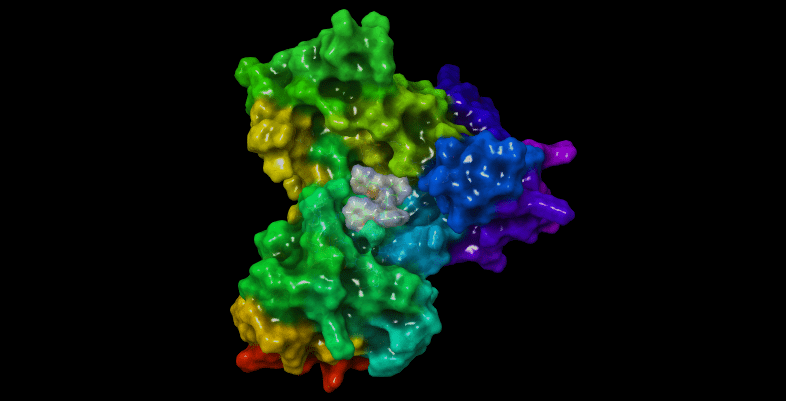
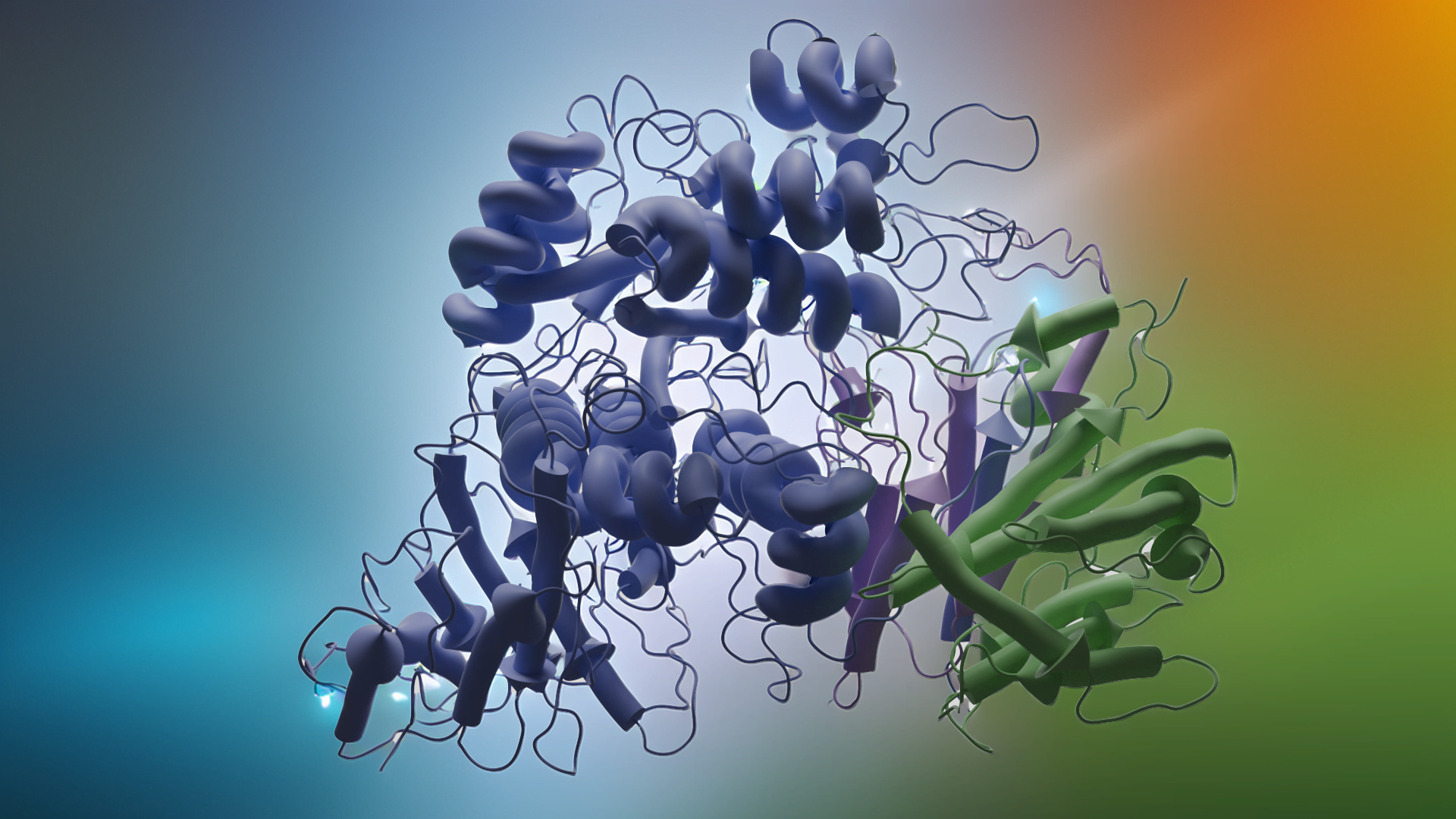
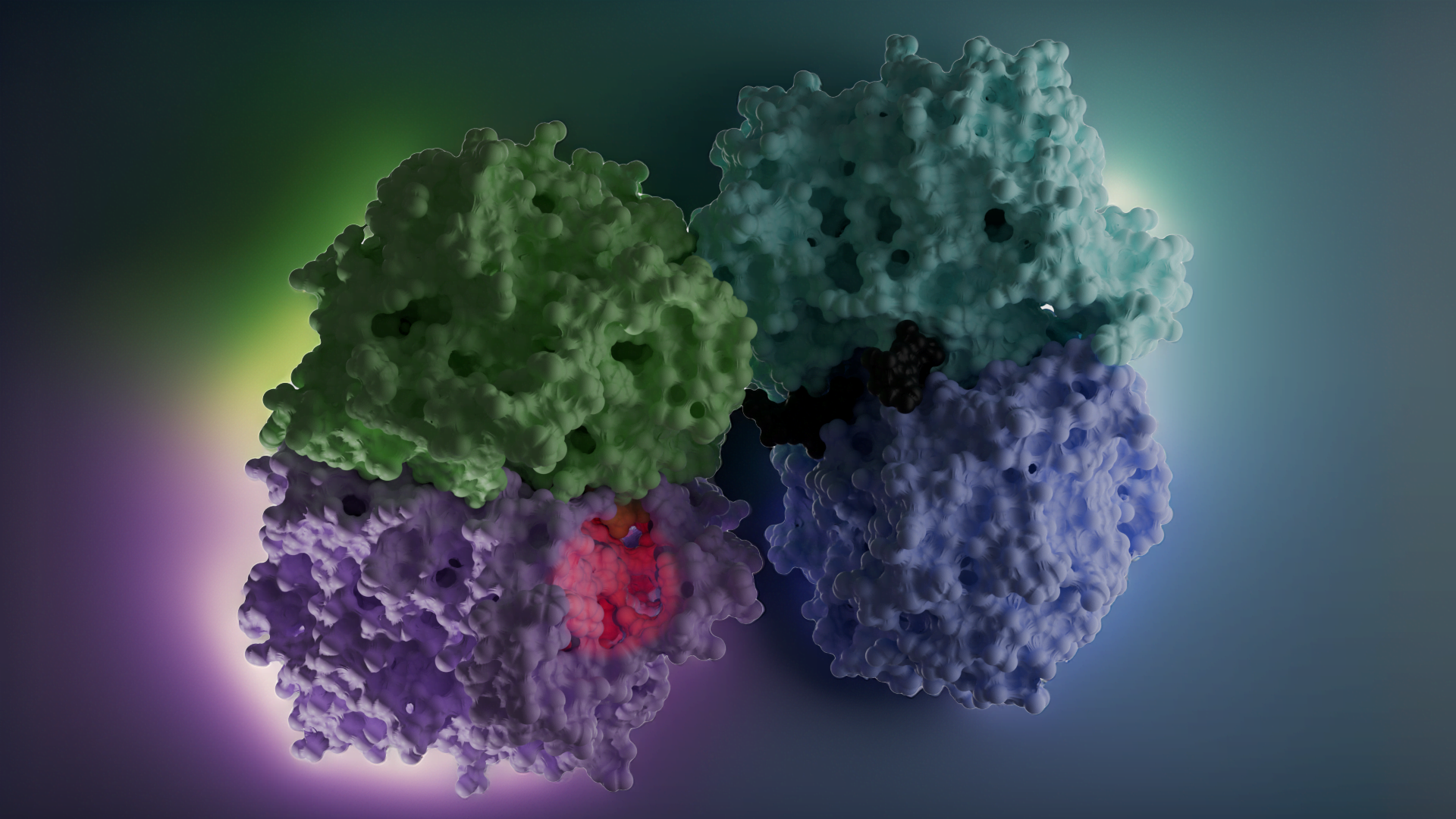
Glutatyon redüktaz (GR, EC 1.8.1.7), prokaryot ve ökaryot hücrelerde bulunan NADPH’ye bağlı oksidoredüktaz bir enzimdir; 2×52 kDa’luk homodimerik flavoproteindir, oksidatif strese karşı hücreyi korur [Dolphin ve ark. (1989)]. Bu antioksidan enzim, glutatyon disülfitin (GSSG, yükseltgenmiş glutatyon) glutatyona (GSH, indirgenmiş glutatyon) indirgenmesini katalizler. GSSG, oksidatif stress ortamında, GSH’nin yükseltgenmesi ile ortaya çıkar, bu esnada diğer reaktif oksijen türleri (ROS) de oluşur. Sitoplazmada GSH/GSSG oranları 30:1 ila 300:1 arasında değişir [Jones (2002); Zhao ve ark.,(2009)]. Yüksek GSH derişimi nedeniyle, GSH/GSSG, hücrenin ana redoks tamponu olarak kabul edilir, GSH/GSSG oranı oksidatif stres koşullarında azalır.
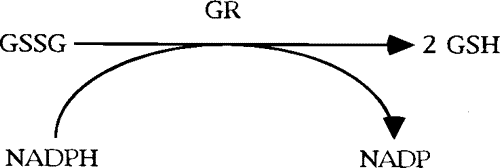
GR inhibitörleri, antimalarya, antikanser ilacı ve kemoterapi/ radyoterapide duyarlılığı arttırma ajanı olarak kullanılmaktadırlar. Sıtma tedavisi için GR enzimini hedef alan ilaçlar ile ilgili pek çok çalışma mevcuttur [Bauer ve ark (2006); Becker ve ark.(2003); Biot ve ark.(2003); Davioud ve ark. (2001)]. Antikanser ilacı olarak kullanılan GR inhibitörleri oksidatif stresi artırarak tümörlerin çoğalmasını engeller. GSSG artışı hücre fonksiyonlarını bozar [Karplus ve ark. (1988)]. Radyoterapinin kanser hücrelerini öldürmesindeki etken ROS üretimidir. GR inhibitörleri oksidatif stresi arttırılarak radyoterapiye destek sağlamaktadır.
Enzimler ile ilgili daha çok bilgi almak için Enzimler ve Genel Özellikleri yazısını okuyunuz.
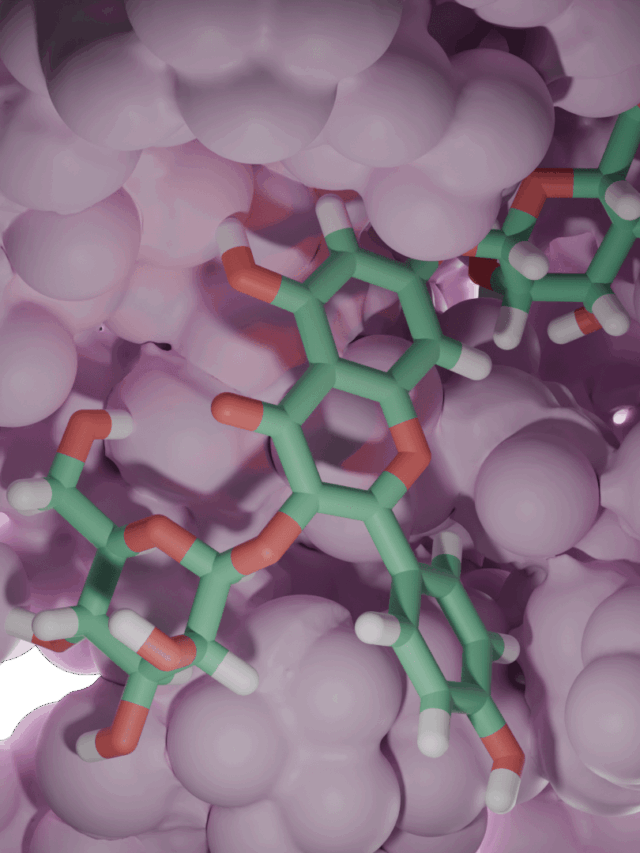
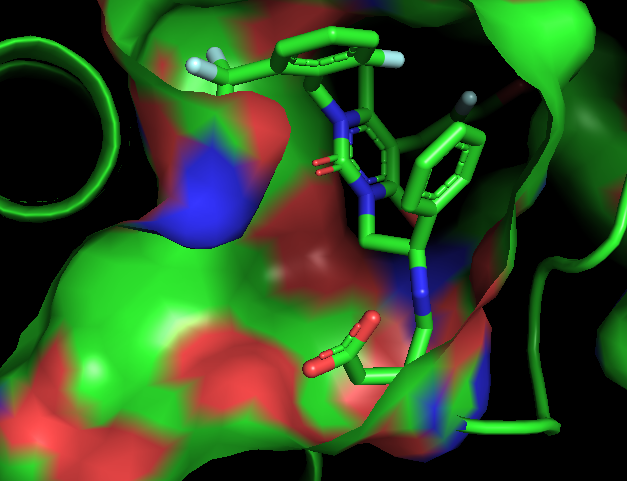
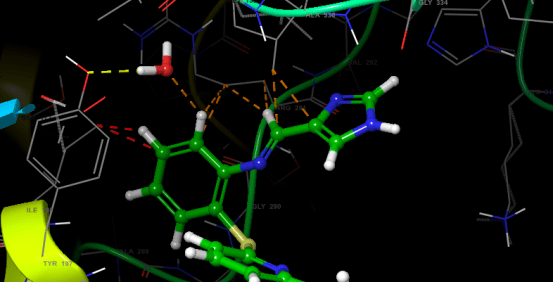
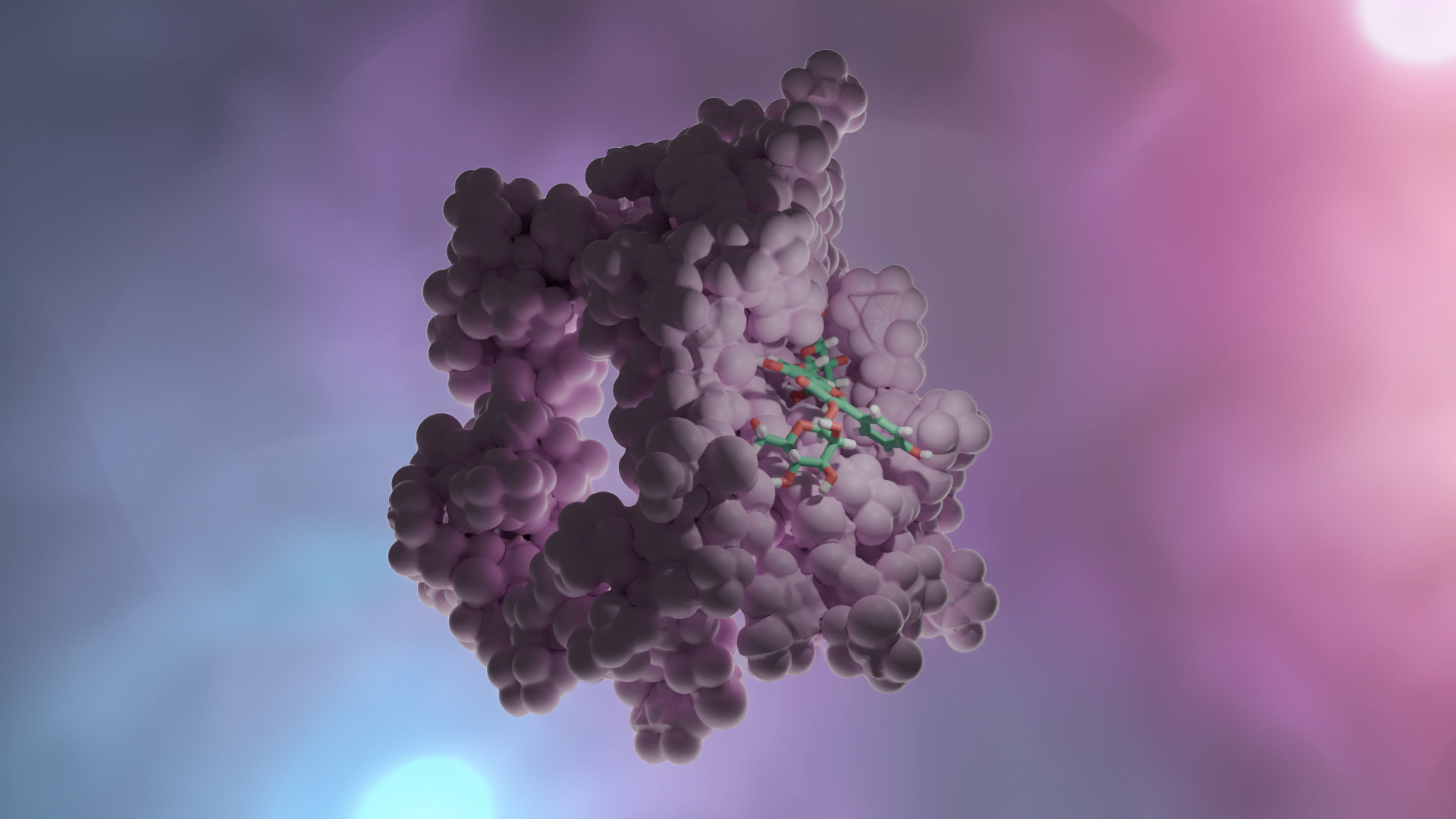
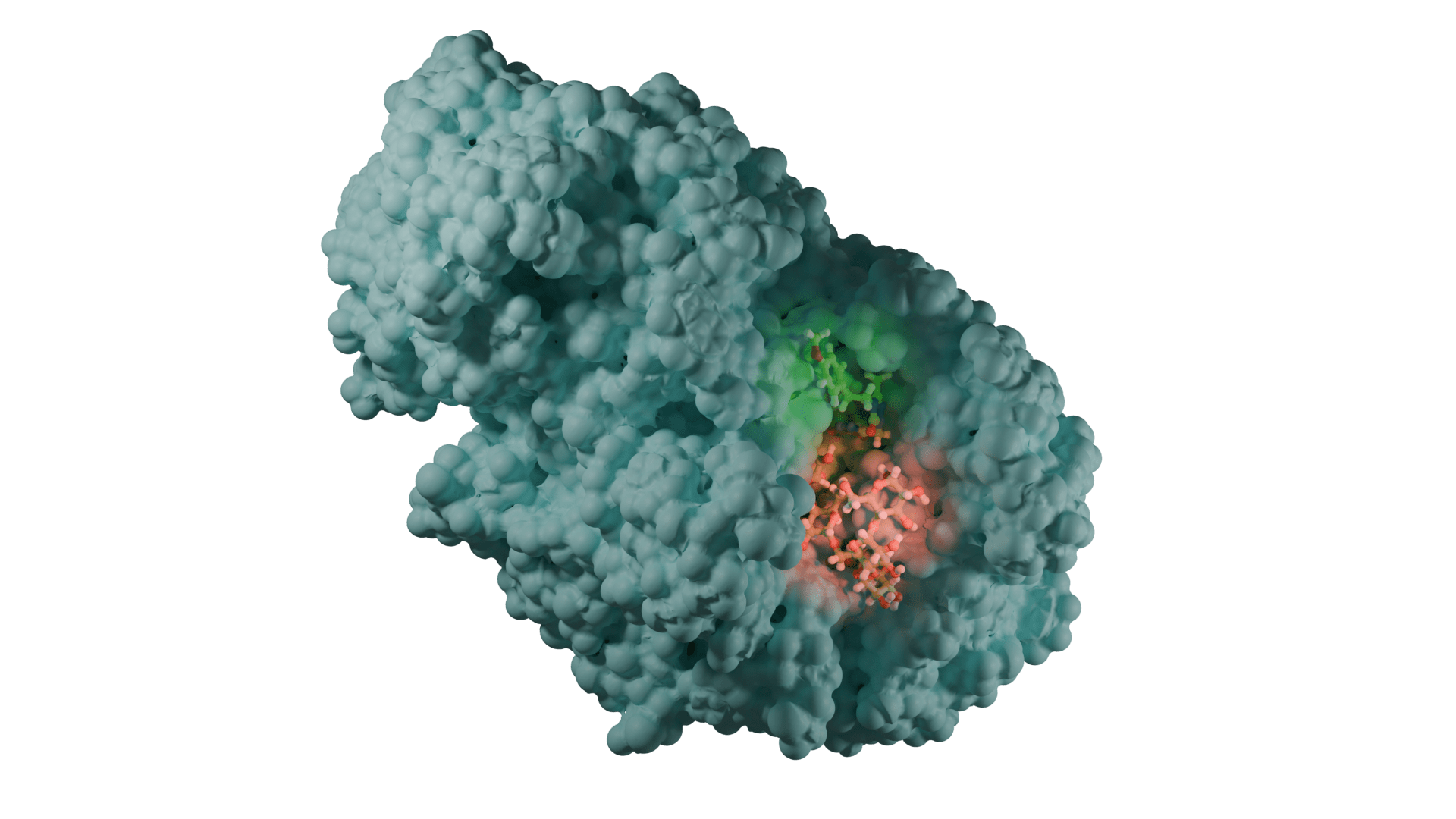
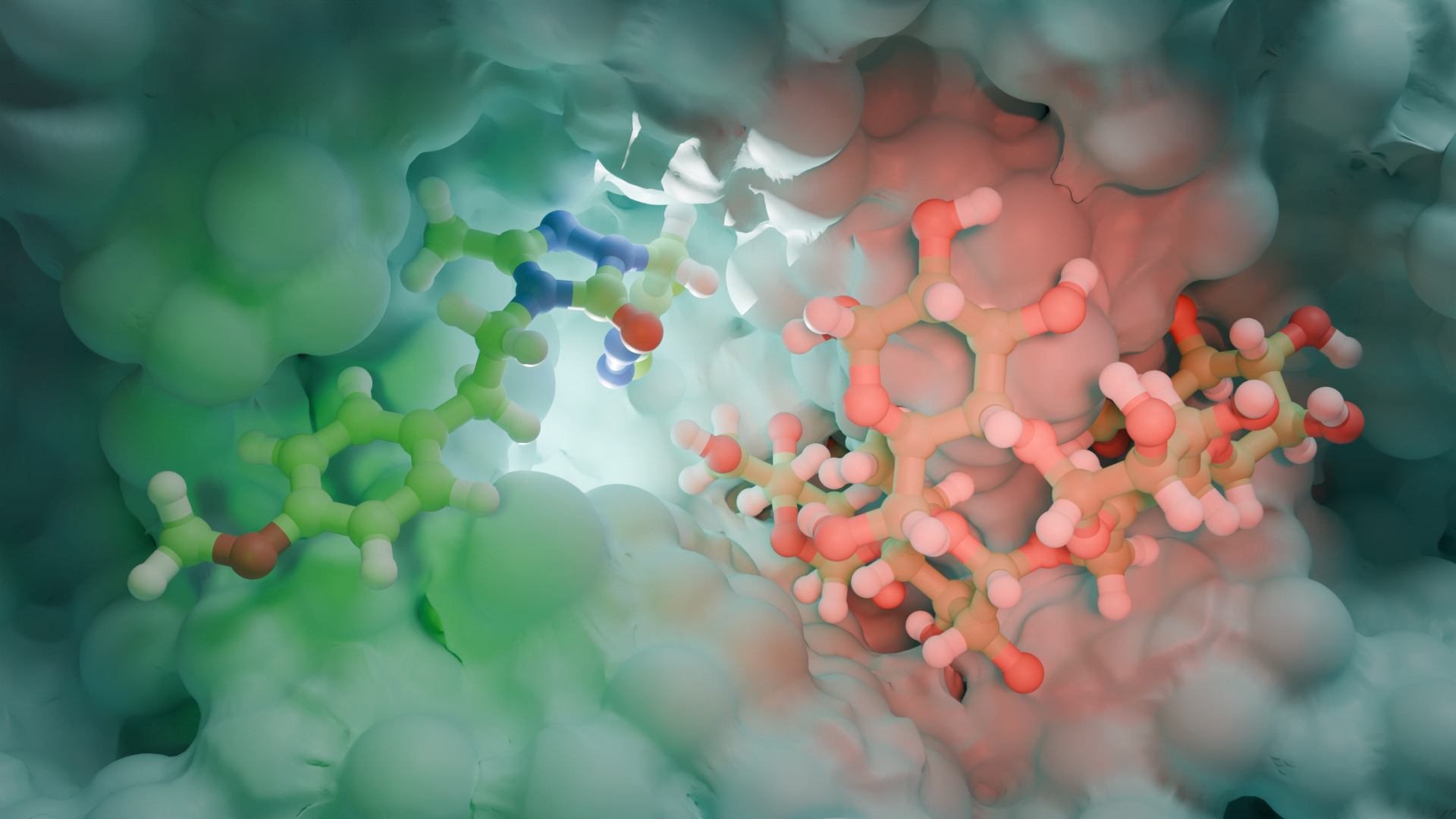
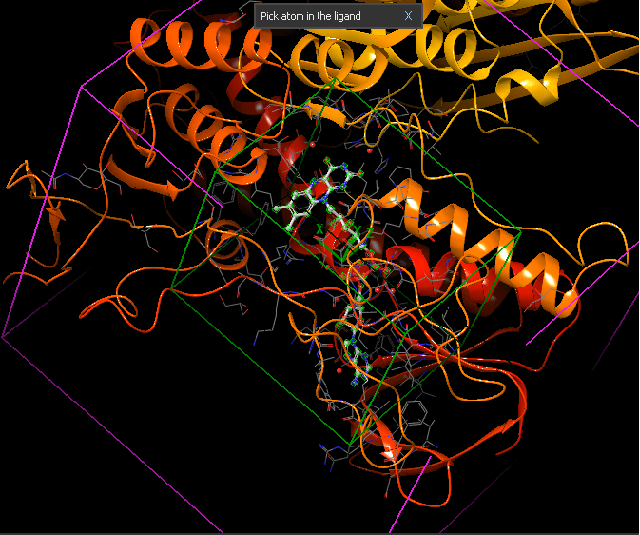
Proje kapsamında kullanılan GR enzimlerinin 3D-kristal geometrileri ile aktif bölge etkileşim yapıları aşağıda verilmektedir.
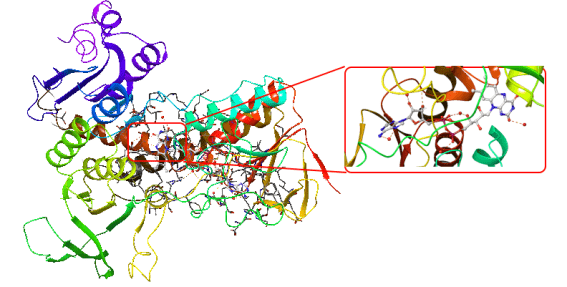
DOI: 10.2210/pdb3DK8/pdb
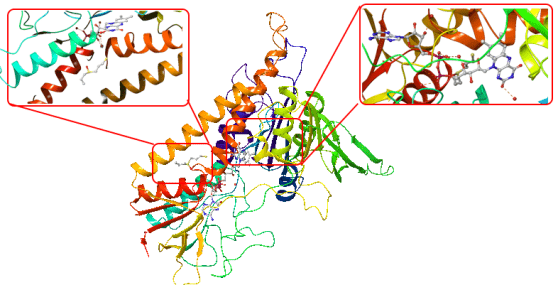
DOI: 10.2210/pdb1BWC/pdb
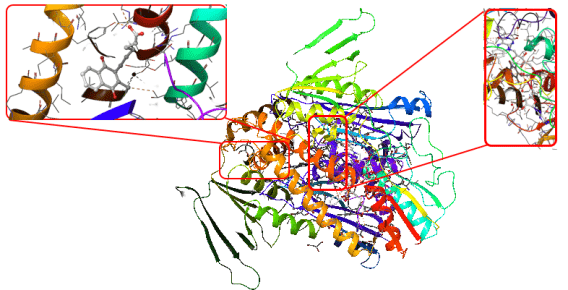
DOI: 10.2210/pdb2GH5/pdb
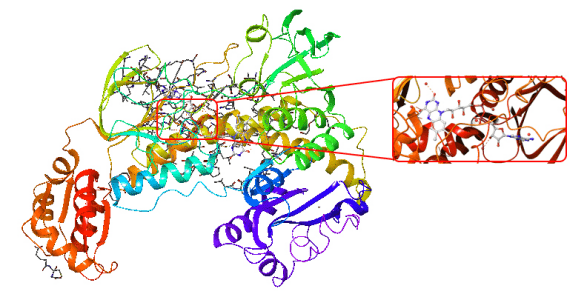
DOI: 10.2210/pdb2HQM/pdb
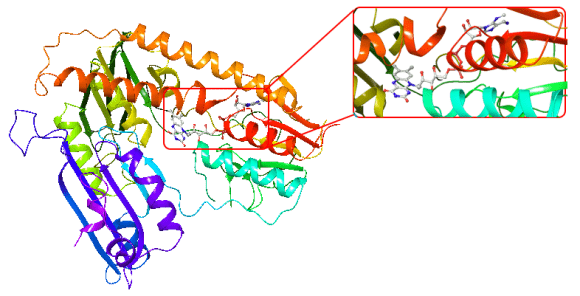
DOI: 10.2210/pdb1ONF/pdb
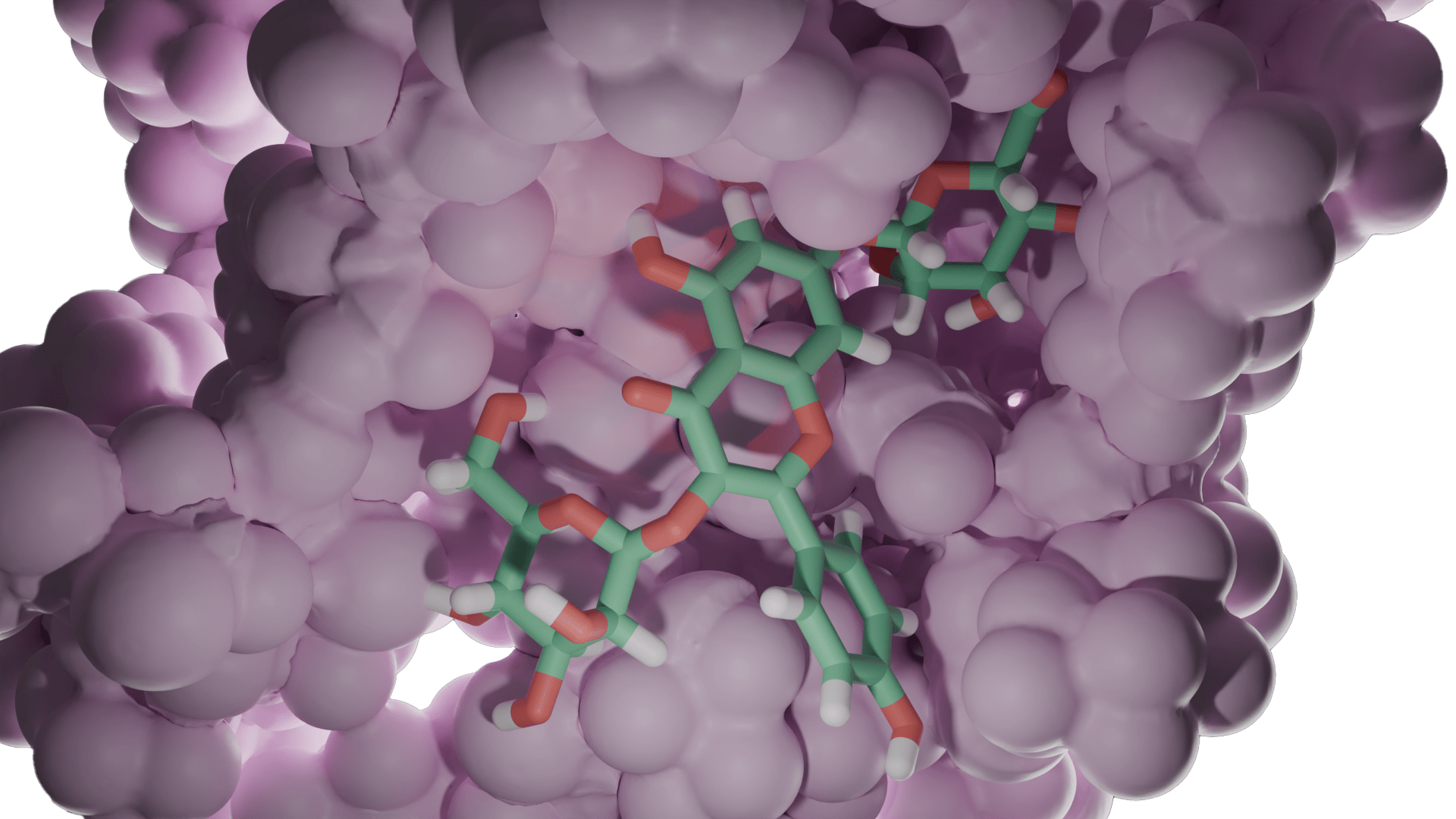
2.2 Schiff Bazları ve Glutatyon Redüktaz
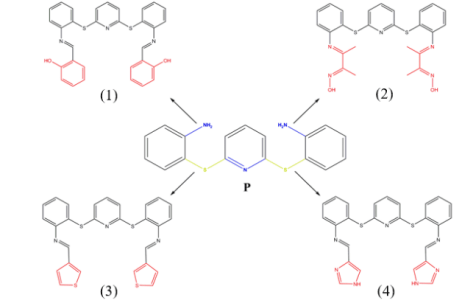
Önce 2,6-disülfanilpiridin-2,2’-dianilin başlangıç bileşiği (P) sentezlenmiş ve yapısı X-ışınları difraksiyon yöntemi ile aydınlatılmıştır (Şekil 2.2a).
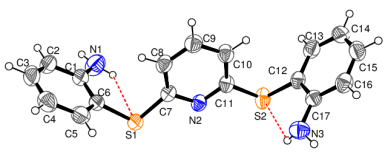
Bu başlangıç bileşiğine çeşitli aldehitler katılarak 4 farklı Schiff Bazı (1-4) sentezlenmiş ve yapıları spektrofotometrik yöntemlerle aydınlatılmıştır (Şekil 2.2b). Bileşiklerin isimleri aşağıda verilmektedir.
(1) 2,6-Bis (2-{(Z)-[(2-sülfanilfenil)iminometil}fenol)piridin
(2)2,6-Bis(2-{[(1Z,2E)-2-(hidroksimino)-1-metilpropiliden]amino}-benzentiyol) piridin
(3) 2,6-Bis (2-{[(1Z)-tiyofen-2-il-metiliden]amino}benzentiyol)piridin
(4) 2,6-Bis (2-{[(1Z)-1H-imidazol-4-il-metiliden]amino}benzentiyol)piridin
Bu bileşiklerin ekmek mayası ve insan eritrositinden izole edilmiş GR enzimleri üzerindeki etkileri in vitro çalışılmış ve IC50 değerleri Çizelge 2.2 de verilmiştir.
Çizelge 2.2. Bileşiklerin glutatyon redüktaz aktivite IC50 değerleri
| Bileşikler | Ekmek mayası IC50 (µM) | İnsan eritrositi IC50 (µM) |
| P | 135.62±1.00 | 143.14±1.07 |
| (1) | 55.23±0.27 | 66.87±0.36 |
| (2) | 52.42±0.71 | 63.56±0.25 |
| (3) | 50.09±0.67 | 56.12±0.69 |
| (4) | 15.06±0.58 | 15.89±0.71 (AC50) |
| Chloroquine | 1.25±0.17 | 1.92±0.19 |
Bileşikler (P, 1-3) glutatyon redüktaz enzimine karşı inhibitör etkisi gösterirken, 4 nolu bileşik enzim aktivatörü olarak davranmaktadır. Şekil 2.2c de (1) ve (4 ) nolu Schiff bazlarına ait ekmek mayası GR % aktivite– derişim grafiği verilmektedir. Grafiklerden görüldüğü gibi (1) inhibitor, (4) aktivatör olarak davranmaktadır. En iyi inhibitör etkisini (1) nolu Schiff bazı göstermektedir. Tüm bileşikler, ekmek mayası GR enzimine karşı daha fazla aktivite göstermektedir.


Yukarıdaki grafikler L1 ligandının ve L4 ligandının birbirinin zıttı etki yaptığını göstermektedir. Glutatyon redüktaz enzim aktivitesi uygulanan ligandlara göre aktivatör ve inhibitör etki göstermiştir. Bu konunun daha kapsamlı analizinin yapıldığı Antimalaryal İlaçlar – Yapı Bazlı İlaç Tasarımı yazında bu konu nedenleri ile birlikte tartışılmaktadır.
Menu
Biraz Müzik İyi Gider! Playlist’i Kaydet ve Odaklanmak için Spotify Hesabından Her Zaman Ulaş. Play’e Basmayı Unutma ;)
Videolara Göz At! Artık Her Şey Hareketli! Yeni Bilgiler Edin! Moleküler Dinamik Simülasyonları Bilimin Önemli Konularından.