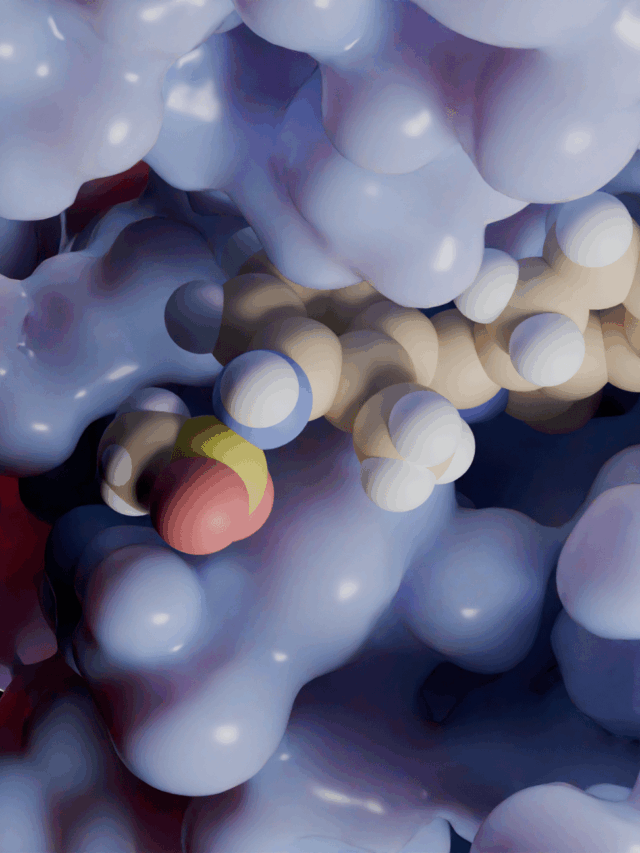Enzim inhibitörü enzimlerin çoğunun protein yapısında olması sonucu ortaya çıkan bir prensiptir. Kanser de dahil olmak üzere pek çok hastalığın tedavi süreçlerinde enzim inhibitörü niteliğinde ilaçlar kullanılmaktadır. Anti kanser ajanı olarak kullanılan bir enzim inhibitörü için yapılan bir araştırmayı daha önce yazımda incelemiştir. Protein yapısında olmayan olmayan enzimler ise katalitik RNA molekülleridir. Enzimlerin yapılarınınn protein yapılı olduğu düşünüldüğünde enzimin işlev ve çalışma mekanizmaları protein yapının konformasyonel bütünlüğüne bağlıdır. Bu bütünlüğün bozulması enzimin işlevini kalıcı veya geçici olarak yerine getirememesi demektir. Bu protein yapısının harici bir molekül, atom veya herhangi bir yapı ile bozulmasına inhibisyon -yani engelleme denmektedir.
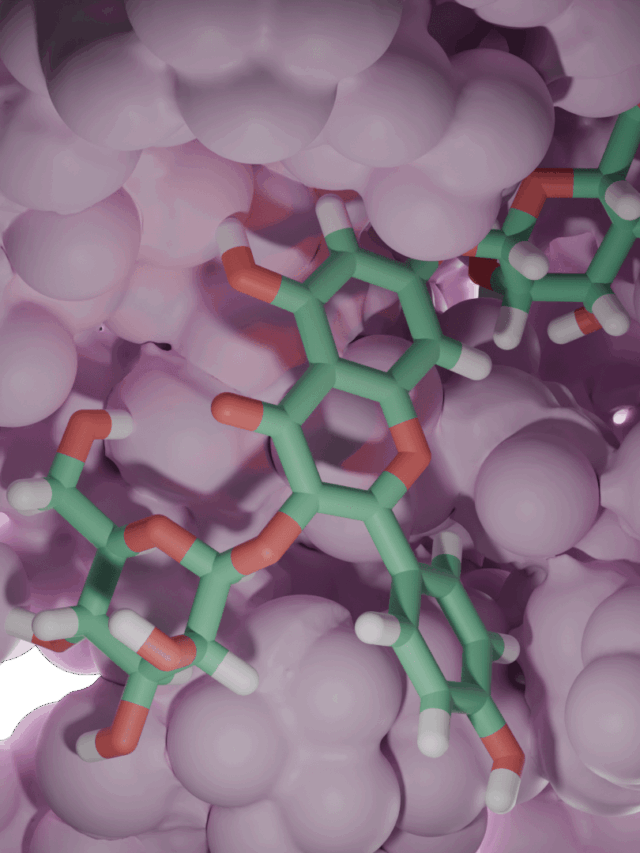
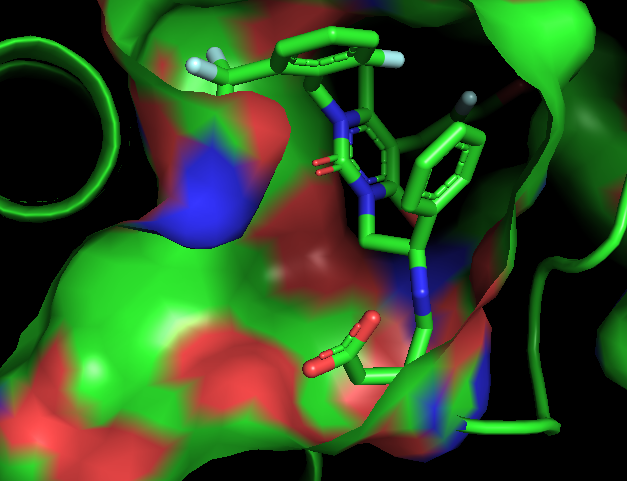
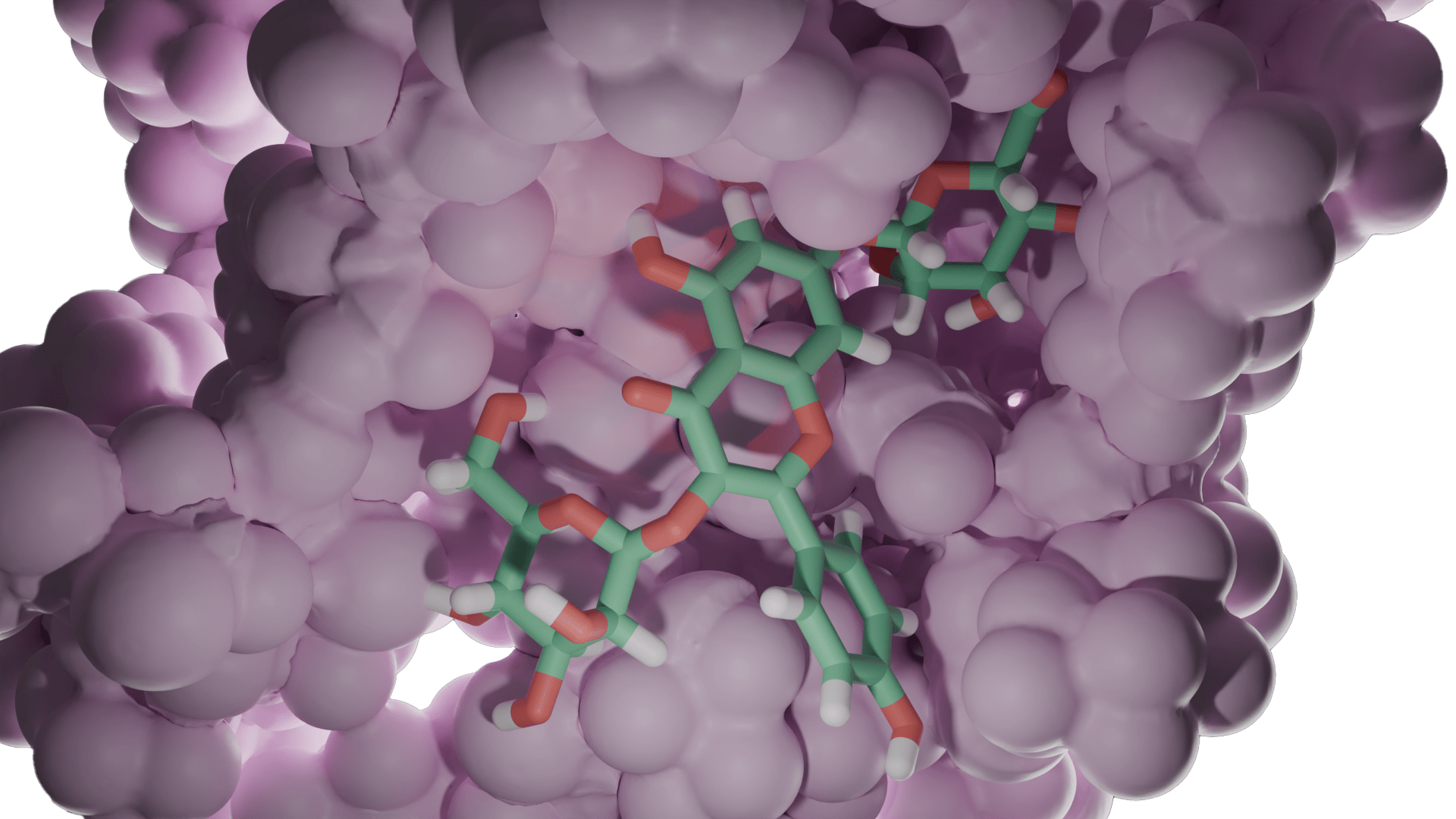
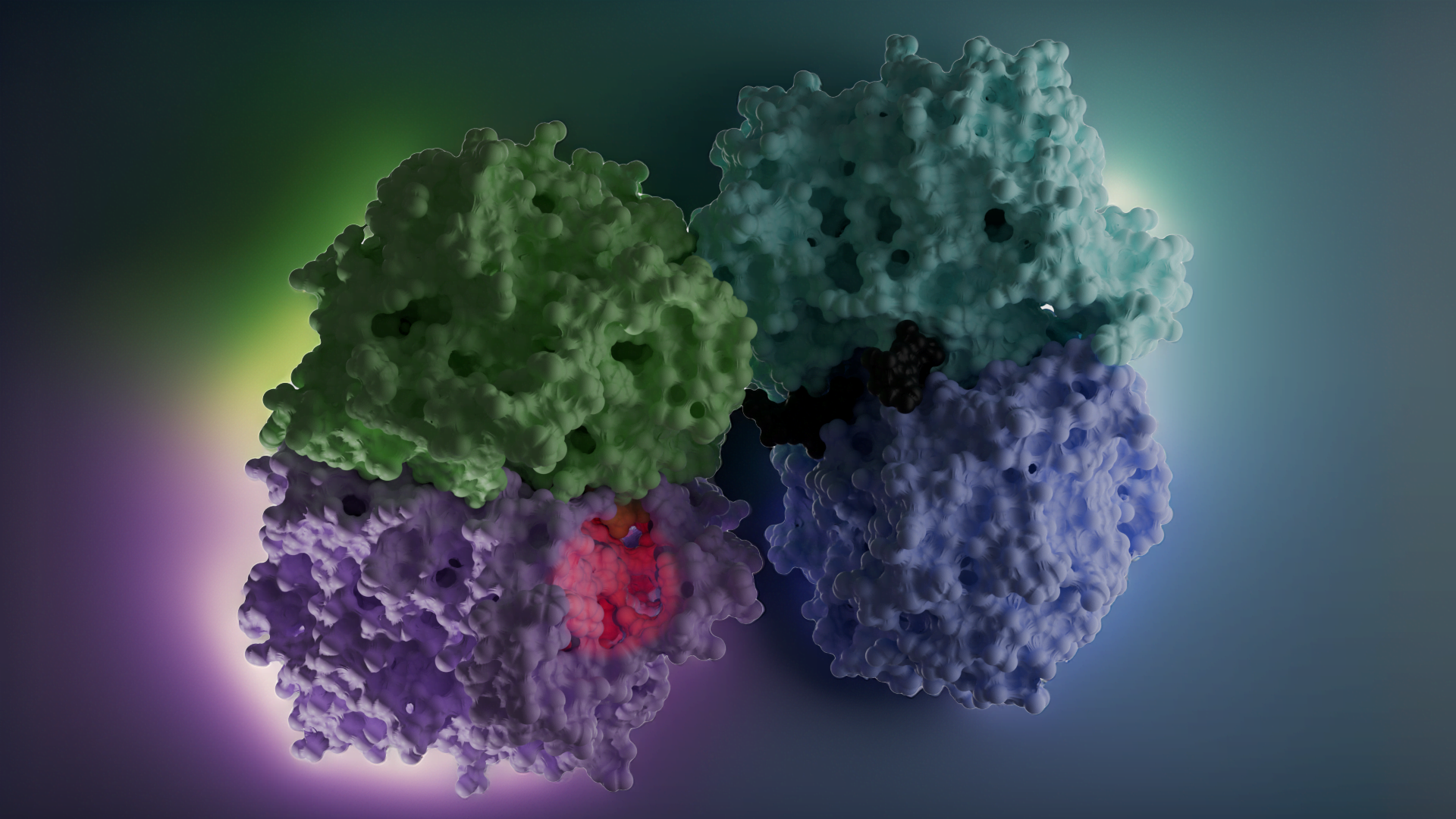
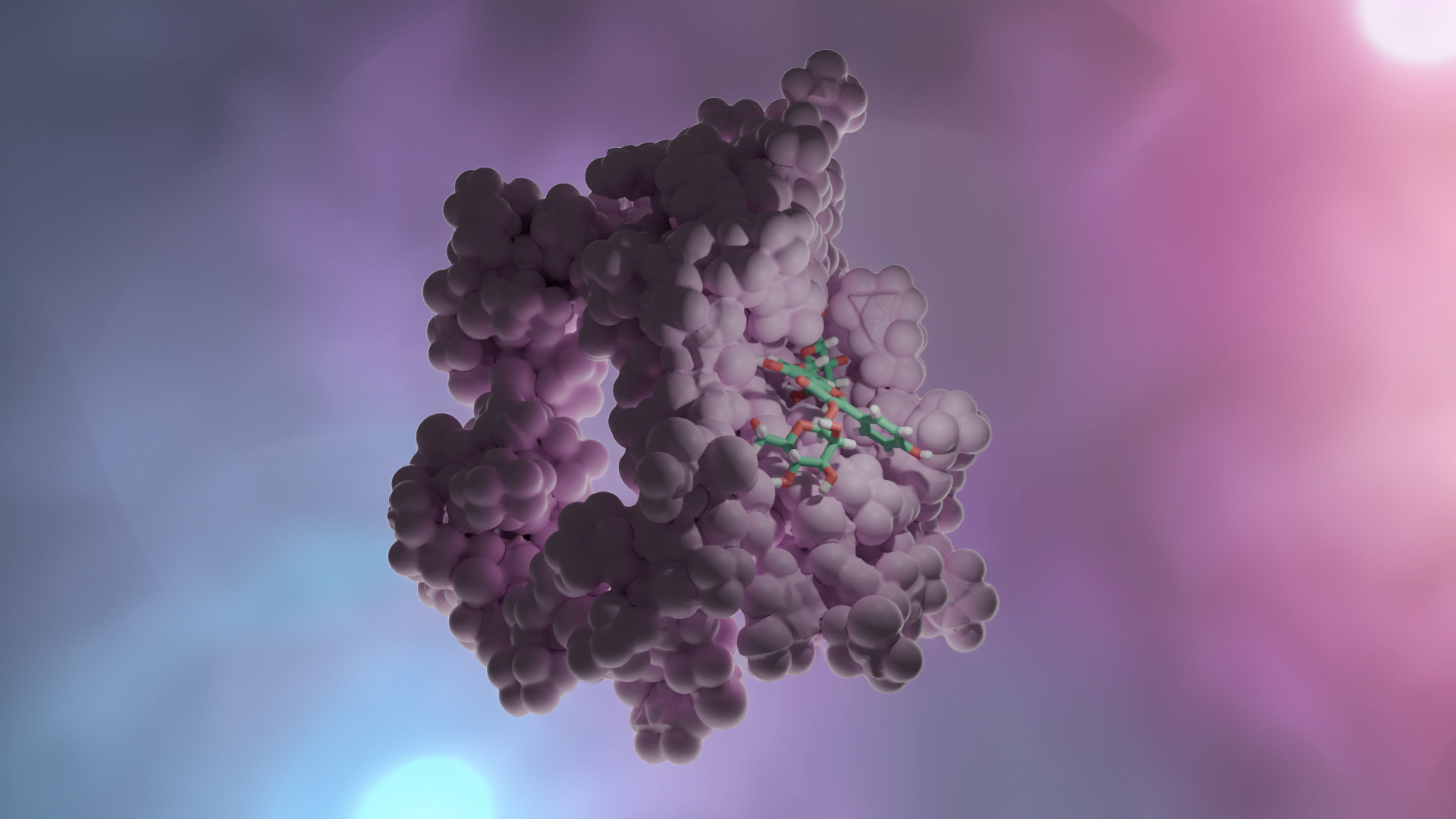
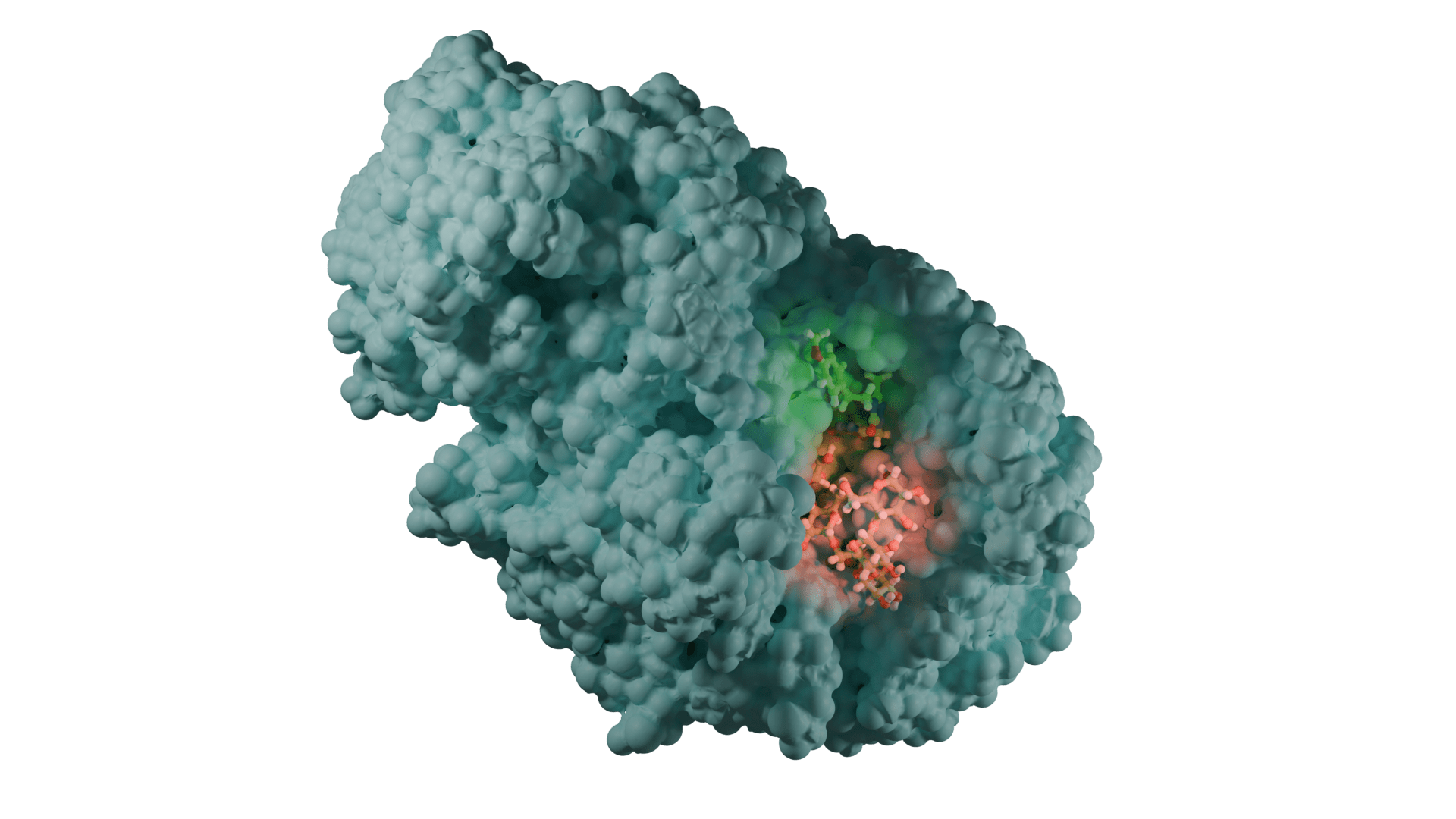
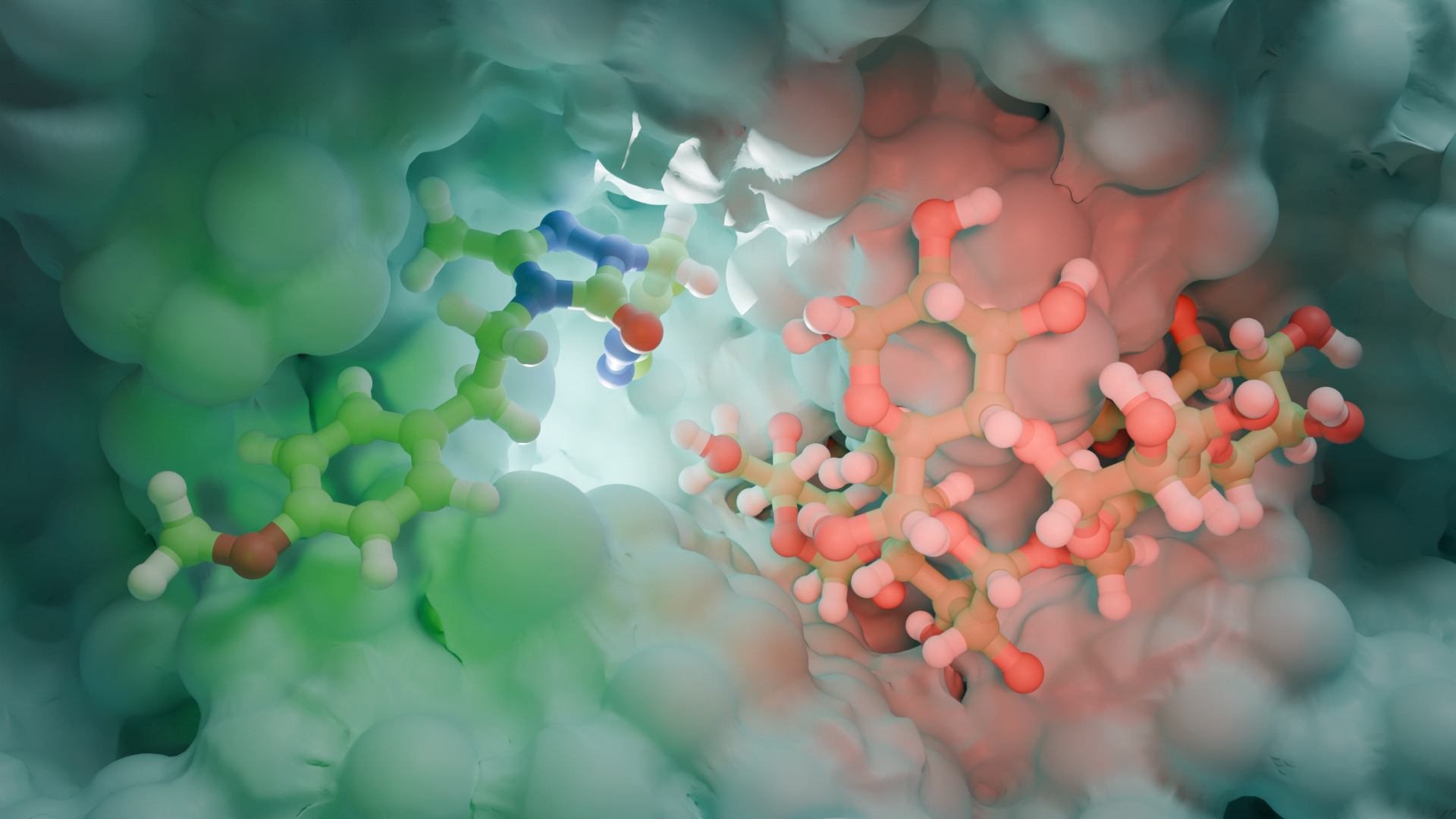
Enzim inhibitörü işleyişi kovalent olmayan etkileşimlerle olduğundan her zaman geçicidir. Ancak kovalent etkileşim ile meydana gelen inhibisyonda protein yapının bütünlüğü tamamen bozularak enzim işlevsiz hale gelir. İnhibisyon işleyişinin non-kovalent etkileşimler inhibe edildiği olaylara örnek olarak; glutatyon redüktazın, 4-aminokinolin türevi bileşiklerle inhibe edilmesi verilebilirken, kovalent enzim inhibitörü için örnek olarak günümüzde büyük bir sorun teşkil eden ve tüm dünyaya yayılmış olan COVİD-19 virüsünün proteaz enzimine kovalent etkileşim(glutatyon redüktaz örneğindeki ki gibi non-kovalent etkileşimler de tabi ki çalışılmaktadır) yapacak moleküller aranmaktadır. Kovalent etkileşim ile inhibisyona ve non-kovalent etkileşim ile inhibisyona ait görseller aşağıdadır.
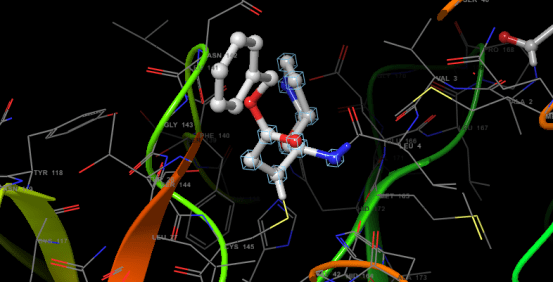
DOI: 10.2210/pdb6LU7/pdb
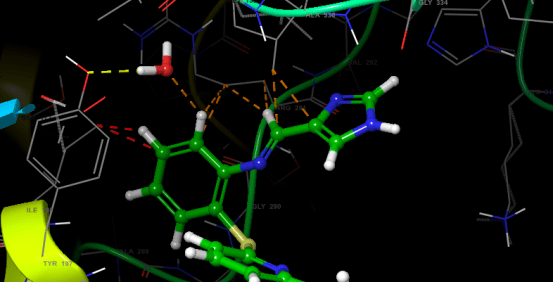
DOI: 10.2210/pdb3DK8/pdb
Non-Kovalent Enzim İnhibitörü Dört Çeşittir
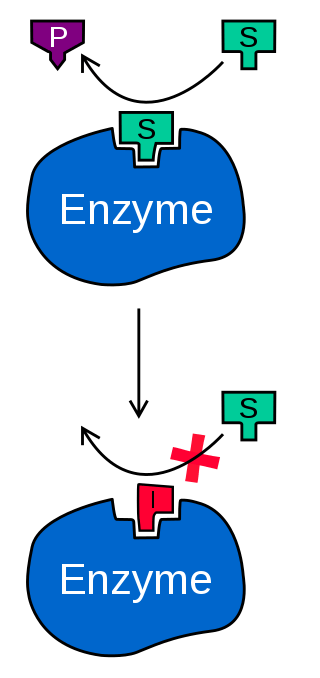
Yarışmalı İnhibisyon ve İnhibitörler
Yarışmalı İnhibisyonda, substrat ve enzim inhibitörü enzime farklı zamanlarda bağlanır. Bunun yerine enzim inhibitörü substrattan önce aktif merkeze bağ yapmıştır. Yani substrata bağlancak yer kalmamıştır. Bunun olablmesi için tabiki inhibitör molekülün substrattan daha büyük bir bağlanma isteğine sahip olması gerekir.
Yarışmasız İnhibisyon
Yarışmasız inhibisyonda, enzim inhibitörü substrat-enzim kompleksine bağlanır. Bu de enzim işlevinin ya tamamen ortadan kalması yada enzim işlevinin yavaşlaması anlamına gelmektedir. İnhibitör substrat enzim kompleksinde enzimdeki olası bağlanma bölgelerine bağlanarak enzimin protein yapısında konformasyonel bir değişme meydana getirir.
Karışık İnhibisyon
Karışık inhibisyonda, inhibitör ve substrat aynı zamanda enzime bağlanabilir. Ancak, inhibitörün bağlanması substratın bağlanmasını, substratın bağlanması da inhibitörünkünü etkiler. Substratın konsantrasyonunu artırmakla bu tip inhibisyon azaltılabilir ama tamamen üstesinden gelinemez. Karışık tipli inhibitörlerin aktif bölgeye bağlanması mümkün olmakla beraber, bu tip inhibisyon genelde inhibitörün enzim üzerinde başka bir yere bağlanmasından kaynaklanan allosterik bir etkinin sonucudur. İnhibitörün allosterik yere bağlanması, enzimin konformasyonunu değiştirir, öyle ki substratın aktif bölgeye olan afinitesi azalır.
Enzim İnhibisyon Türlerini Açıklayan Grafikler
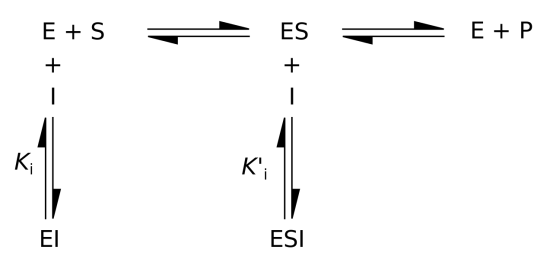
Yukarıdaki şema tersinir inhibisyonun genel bir gösterimi olup, enzim inhibisyonunun kinetiği ile ilgili bilgiler vermektedir. ESI inhibitörün ES kompleksine bağlandığını ifade etmektedir. Yani bu yarışmasız inhibisyonun gösterimidir. EI ise yarışmalı inhibisyonun gösterimidir. Şemada görüldüğü gibi İnhibitor ES kompleksi oluşmak yerine EI kompleksi oluşmuş ve enzim inhibe edilmiştir. Burada her ne kadar yarışmalı inhibisyon ve yarışmasız inhibisyon bir arada gösterilse de ve bir birini takip ediyor olarak görünsede iki inhibisyon türü ayrı ayrı da değerlendirilebilir ve ayrı ayrı da etkili şekilde enzim inhibisyonu yapabilir.
Bu şemadan yola çıkarak ve tepkimelerin denge halinde olduğunu düşünerek br takım kinetik çıkarımlar yapmak mümkündür. Bu kinetik çıkarımlarda elde edilen sonuçların grafiğe aktarılası enzim inhibisyonunun kinetiği hakkında önemli bilgiler vermektedir.
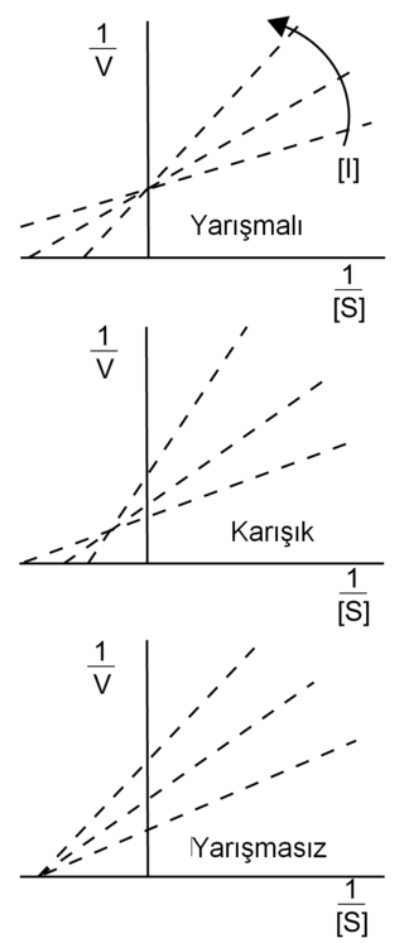
Yukarıdaki grafikler enzim inhibisyonu için enzim inhibitörü türlerinin Lineweaver-Burk grafikleridir. Burada 1/V değerlerinin inhibisyon ile ve inhibisyon türü ile nasıl bir ilişki içinde olduğu görülmektedir. Yarışmasız inhibisyona baktığımızda 1/V değeri inhibisyon ile artarak dik ekseni farklı yerde kesimiş ve inhibisyon sağlanıştır. Bu inhibisyonda 1/S değerinin çıkış noktaları aynıdır ve substrat derişimini göstermektedir. Bu konuyla ilgili olarak şuan HIV virüsünün tedavisinde kullanılan bir ilacın nasıl çalıştığı mekanizmasını öğrenmek için Raltegravir – İntegraz İnhibitörlerinin İlki bakabilirsiniz. Ayrıca milli olanaklar ile seri üretimi yapışan favicovir ilacının etki mekanizmasını, yapısını ve özelleklerini incelemek için Favicovir – Covid-19’a Karşı Milli İlaç adlı yazıyı okuyabilirsiniz.
Yarışmalı inhibisyona baktığımızda enzim ile etkileşen substrat miktarında farklılaşma vardır çünkü inhibitör substratla etkili bir biçimde yarışmaktadır. Bir ligandın inhibitör çeşitleri bakımından ayrıntılı incelenmesi bilgisayar simülasyonları tarafından hesaplamalı kimya ile yapılabilmektedir. Bu konu ile ilgili daha çok bilgi almak için Moleküler Dinamik Simülasyonları yazısını okuyunuz. Yazıda bir inhibisyon mekanızmasının bilgisayar simülasyonları ile nasıl görselleştirildiği anlatılmaktadır.
Karışık inhibisyonda ise hem yarışmalı hem de yarışmasız inhibisyonun bir birleşmi olduğunu grafiksel olarak da ortaya koymaktadır. Hem substrat derişimi(veya miktarı da diyebilir) hem de enzimatik tepkimenin devamında iki inhibisyon türünün özelliklerini göstermektedir.
Enzim inhibisyonunun prensipleri protein yapıların geneli için geçerlidir. Buna örnek olarak Risin Proteini ile ilgili yazıyı okuyabilirsiniz.
Enzim inhibitörü olarak kullanılan ilaçların nasıl tasarlandığını ve keşfedildiğini öğrenmek için bilgisayar destekli ilaç tasarımını anlattığımız yazıma ve etkili bir enzim inhibitörü için enzim üzerinde yapılan in vitro testlerin sonuçlarına bakmak için glutatyon redüktaz enzim aktivitesi yazımıza bakabilirsiniz.
Menu
Biraz Müzik İyi Gider! Playlist’i Kaydet ve Odaklanmak için Spotify Hesabından Her Zaman Ulaş. Play’e Basmayı Unutma ;)
Videolara Göz At! Artık Her Şey Hareketli! Yeni Bilgiler Edin! Moleküler Dinamik Simülasyonları Bilimin Önemli Konularından.